2022�N�x
2023.3.23-24
������w��w�@�w�ʋL���^���A������w��w�����Ǝ����s���܂����B����������͔��m�ے�3���A�C�m�ے�6���A�w���w��5�������Ƃ��܂����B���߂łƂ��������܂��I
2023.3.24
����������w�@���A�x�R�N�q�y�����ɂ��_��"Soluble form of the APP fragment, sAPP��, positively regulates tau secretion"���A�N�Z�v�g����܂����B
2023.3.14
�����M�v���m�̃Z�~�i�[���J�Â���܂����B�ڍׂ������� �ł��B
2023.3.13
Yung Ning Chu��w�@���A�Ԗx���ʊw�����A�����ď����ɂ�鑍��"Pathological roles of INPP5D in Alzheimer disease"���A�N�Z�v�g����܂����B
2023.3.10-11
3�N�Ԃ�̃��{���s�ɍs���܂����I�ɓ��ł��������A�����فA�f�G�ȃI�[�V�����r���[�A�r�[���H���V���n�����\���܂����I�����̊F�����ς����l�ł����I
2023.3.9
������D��w�@���A�ؑ��V�ތ���w�@���A�@�������w�@���A���đ�w�@���A���J���w�����A����������w�@���A�����ď����ɂ��_��"INPP5D modulates TREM2 loss-of-function phenotypes in a ��-amyloidosis mouse model"���A�N�Z�v�g����܂����I�v���v�����g���J�ł������� �ł��B
2023.2.23
The 19th Conference of Peace through Mind/Brain Science�ɂ����āA�x�c�ו㋳����HIRUMA/WAGNER Award����܂��܂����B
2023.2.15
�헪�I�p�[�g�i�[�V�b�v��w�v���W�F�N�g�̃T�|�[�g�ɂ��ADr. Sangram Sisodia�̃Z�~�i�[���J�Â���܂����B�ڍׂ������� �ł��B
2023.2.1
���菫�猳��w�@���A���R��V������w�@���A�g�V�y������w�@���A�����n�T��w�@���ɂ��_��"ADAMTS4 is involved in the production of the Alzheimer disease amyloid biomarker APP669-711" ���o�ł���܂����B�v���X�����[�X�ɂ��Ă�������i������w�j ��������iJST�j �ł��B
2022.10.12
ISMND2022 �ɂ����āA�����ď�����Poster presentation award����܂��܂����B
2022.9.22
������w��w�@�w�ʋL���^���i�H�G�j�����s����܂����B����������͔��m�ے�1�������Ƃ��܂����B���߂łƂ��������܂��I
2022.9.16
����䂫����w�@���A���y����w�@���A�ɓ�������w�@���A�����z���Y��w�@���A�ɓ������C�u�t�ɂ��_��"The atypical Rab GTPase associated with Parkinson�fs disease, Rab29, is localized to membranes" ���A�N�Z�v�g����܂����B
2022.9.12
������w�L�u�W�vvol. 45 ���W�u�f�p�ȋ^��vs����v �ɕx�c�����̃C���^�r���[���f�ڂ���܂����B
2022.8.30
�x�R�N�q�y�����ɂ��R�����^���["Promotion in the Clearance of Aggregated A�� in vivo using Amyloid Selective Photo-Oxygenation Technology" ���o�ł���܂����B
2022.8.20
��27����{�a�ԃv���e�A�[�[�w��w�p�W�� �ɂ����āA���R��V������w�@����Young investigator award����܂��܂����B
2022.8.1
�ؑ����q�����C�����Ƃ��ďA�C���܂����B
2022.7.1
�x�c�ו㋳�����V�U��q�搶�i��ʌ��j�A���c�\��搶�i���w�n�����ȁj�Əo����������TV�u����~�m�̋��l�����̎G�k�v �̌��J���n�܂�܂����B���T1�{���A�S11�{���J�\��ł��B
2022.6.30
2017�N7��1���Ƀo�C�I�W�F���E�W���p��������ЂƂ̋��������Ɋ�Â��J�݂��ꂽ�Љ�A�g�u���u�]�_�o�������Êw�v���I�����܂����B5�N�Ԃɓn�鋤���������ʂɂ��ẮA����X�ɏ�������ׂ��A�o���Ō�����i�߂Ă����܂��B�{�Љ�A�g�u���̉^�c����ъ����ɂ������Ă����͂����������F�l�ɐ[�����Ӓv���܂��B
2022.6.18
������D��w�@�����A��21�������Ȋw�V���|�W�E��BIO UT �ŗD�G�|�X�^�[�܂���܂��܂����B
2022.6.18
�r�c�N����w�@�����A2022�N�x���{�����w��֓��x����� �ŗD�G���\�܂���܂��܂����B
2022.6.9
�x�R�N�q�y�����A�x�c�ו㋳���ƁA���䋁�����i�������ȗL�@�������w�����j�A���n�m�������i�a�̎R�������j�A�����T��CEO�i�o�[�~���I���E�Z���s���[�e�B�b�N�X�Ёj�̌����`�[�����A�u��R�T��Ƒn����@��[�Z�p��܁v�Љ�l������ʏ� ����܂��܂����I
2022.5.31
�x�V�����w�@���A����t�ގq��w�@���A�x�R�N�q�y�����ɂ�鑍��"Photo-oxygenation as a new therapeutic strategy for neurodegenerative proteinopathies by enhancing the clearance of amyloid proteins" ���A�N�Z�v�g����܂����B
2022.4.23
�������Ői�߂Ă�����F�m�ǗÖ@�ɂ��āA�����Z�u���ŏЉ��܂����B
2022.5.24
���R��V������w�@���A�����n�T��w�@���A�F���ё�w�@���ɂ�鑍��"Mouse models of Alzheimer disease" ���A�N�Z�v�g����܂����B
2022.4.24
�������Ői�߂Ă�����F�m�ǗÖ@�ɂ��āA���ʐM�Ђ���эזE.jp�̃R�����u�����E�J���̑��v �Ɏ��グ�Ă��������܂����B
2022.4.23
�������Ői�߂Ă�����F�m�ǗÖ@�ɂ��āA�T������ �ŏЉ��܂����B
2022.4.16
���F�m�ǗÖ@�̎��p���ɂނ����J�����Ƃɂ��āA�N���E�h�t�@���f�B���OREADYFOR���v���W�F�N�g�����J ���܂����B�v�V�I�ȐV��̊J���Ɍ����āA���x���̂قǁA�ǂ�����낵�����肢�������܂��B
2022.4.1
2022�N�x�A�������ɐV����8���̊w�� �������܂����B���������A�V�^�R���i�E�C���X�̊����g��h�~�ɓw�߂Ȃ���A�_�o�ϐ������A���_�����̗����ɂȂ��镪�q�y�эזE�a�Ԍ����A�����ĐV������b�����w�̊J���ڎw���Ă����܂��B�����ĐV���Ȏ��Ã��_���e�B�̊J���A�\�h�@�̑n�o�Ɍ��������A�����[���h�f�[�^�̗����p�Ȃǂ̎��g�݂��p�����A�Љ�����Ɍ����Ă��������ƍl���Ă��܂��B�Ȃ�2021�N�x�̏o�����ɂ��Ă������� ���������������B
�ŋ߂̌�������i2021�N�܂Łj
2021�N5��27��
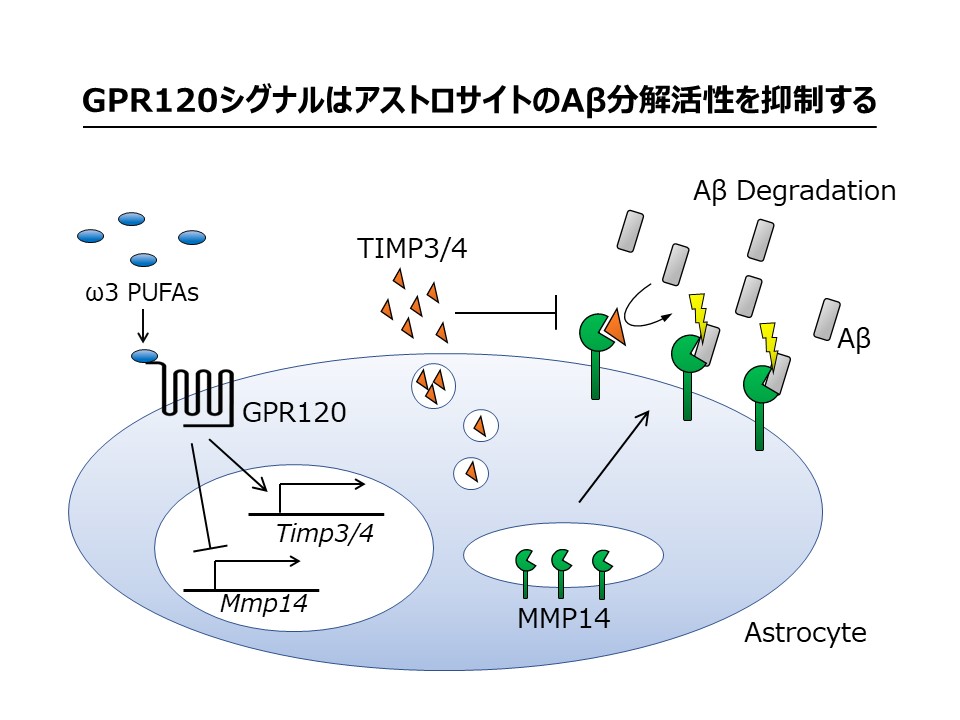
GPR120 signaling controls amyloid-�� degrading activity of matrix metalloproteinases. Kazunori Kikuchi, Takuya Tatebe, Yuki Sudo, Miyabishara Yokoyama, Kiwami Kidana, Yung Wen Chiu, Sho Takatori, Makoto Arita, Yukiko Hori, Taisuke Tomita J. Neurosci., 41(28):6173-6185, 2021.
����܂ł̌�������A�A�~���C�h���iA���j��ӂ̔j�]���A���c�n�C�}�[�a�iAD�j�̕a�Ԍ`���ɉe����^���邱�Ƃ�������Ă��܂��B�]��A����ӂɂ̓A�X�g���T�C�g��A�������y�f���Y�����邱�ƂŊ֗^���Ă��܂����A���̏ڍׂȐ��䃁�J�j�Y���ɂ��Ă͕s���ł��B�{�����ł́A��3���b�_��e�̂ł���GPR120�̃V�O�i�����A�X�g���T�C�g��A������������}�����邱�Ƃ����o���܂����B�܂��A���̃��J�j�Y���Ƃ��āAGPR120�V�O�i����A�������y�f��1�ł���Matrix metalloproteinase 14�iMMP14�j�̊�����}�����邱�Ƃ𖾂炩�ɂ��܂����B�����āAGPR120�Ւf��̓��^��AD���f���}�E�X�]����A���ʂ������Ɍ������������Ƃ���A����GPR120�V�O�i����AD�̐V�K�n��W�I�ƂȂ邱�Ƃ����҂���܂��B�{�������ʂ͌c��`�m��w��w���Ƃ̋��������Ƃ��čs���܂����B
2021�N5��25��
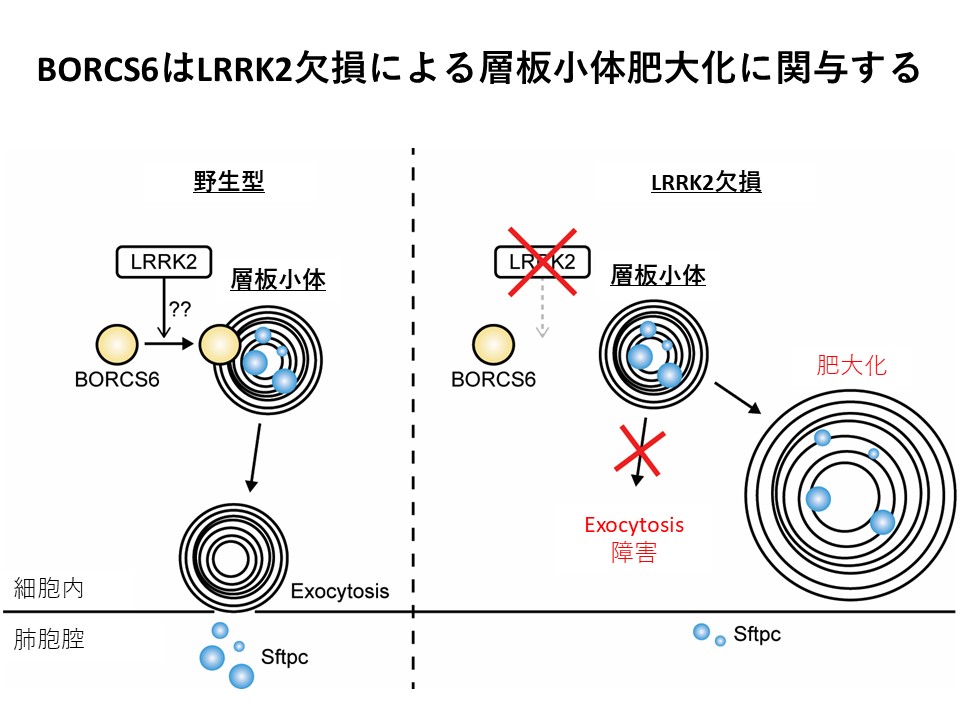
BORCS6 is involved in the enlargement of lung lamellar bodies in Lrrk2 knockout mice. Miho Araki, Kyohei Ito, Sho Takatori, Genta Ito, Taisuke Tomita Hum. Mol. Genet., i30(17):1618-1631, 2021. https://doi.org/10.1101/2021.03.05.434068.
Leucine-rich repeat kinase 2 (LRRK2)�͉Ƒ����p�[�L���\���a�̌�����`�q�Ƃ��Ēm���Ă��܂��BLrrk2�������������}�E�X�̔x�ł͑w���̂ƌĂ�郊�\�\�[���֘A�I���K�l������剻���邱�Ƃ���ALRRK2�͑w���̂̌`�Ԃ�@�\�ێ��Ɋ֗^���邱�Ƃ���������Ă��܂��B�������A���̏ڍׂȕ��q���J�j�Y���͖��炩�ł���܂���B�{�����ł̓v���e�I�~�N�X��͂ɂ��A�쐶�^�}�E�X��Lrrk2�����}�E�X�̑w���̃v���e�I�[�����r���ABORCS6��LRRK2�̉����őw���̂̔�剻�Ɋ֗^���邱�Ƃ𖾂炩�ɂ��܂����B�܂��ALRRK2-BORCS6�o�H���w���̂̃G�L�\�T�C�g�[�V�X�𐧌䂷�邱�Ƃ��������܂����B�{�����̐��ʂ͖������炩�ɂ���Ă��Ȃ��]�ɂ�����LRRK2�̋@�\�𖾂ɂȂ��邱�Ƃ����҂���܂��B�{�������ʂ̓o�C�I�W�F���E�W���p���Ƃ̎Љ�A�g�u���ɂ����鋤���������ʂł��B
2021�N4��14��
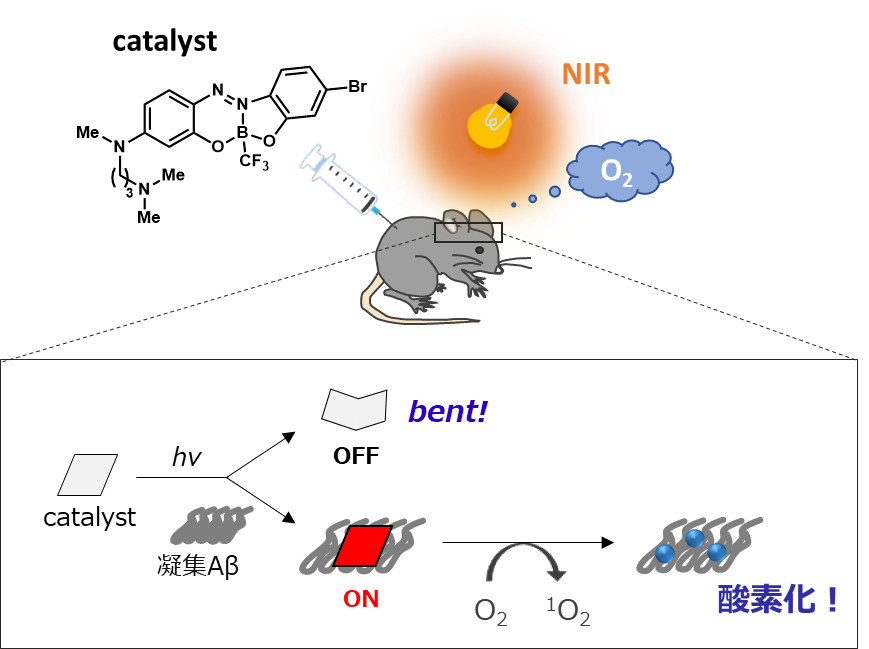
Photo-oxygenation by a biocompatible catalyst reduces amyloid-�� levels in Alzheimer's disease mice. Shuta Ozawa, Yukiko Hori, Yusuke Shimizu, Atsuhiko Taniguchi, Takanobu Suzuki, Wenbo Wang, Yung Wen Chiu, Reiko Koike, Satoshi Yokoshima, Tohru Fukuyama, Sho Takatori, Youhei Sohma, Motomu Kanai, Taisuke Tomita Brain, awab058, https://doi.org/10.1093/brain/awab058.
�A���c�n�C�}�[�a�iAD�j�̔��nj����̈�Ƃ��āA�]����amyloid �� peptide�iA���j���ÏW�E�~�ς��邱�Ƃ��������܂��B��X�͂���܂ŁA�����L�@�������w�����̋��䋁�����A���n�m���O���[�v���[�_�[�Ƌ��ɁA���h���ɂ���Ċ������������_�f���G�}���J�����AA���ɑ���I��I�Ȏ_�f���q�t���ɂ���ċÏW��j�Q����헪�����o���Ă��܂����B����AAD���f���}�E�X�]���ɂ�����A���̌��_�f���ɐ������A���_�f���ɂ��ÏW�}�����ʂ����łȂ��A�ÏWA���̕����E���������i���邱�Ƃ����o���܂����B�܂��A���_�f�����ꂽ�ÏWA���̕����E�����@�\�ɁA�]���Ɖu�S���זE�ł���~�N���O���A���֗^���邱�Ƃ����炩�ɂ��܂����BAD���Ҕ]�R����A���ɑ��Ă����_�f�����\�ł��邱�Ƃ����o���Ă���A�����̌������ʂ́A����A���_�f���G�}��p����AD�ɑ���V�K�\�h�E���Ð헪�̒Ɍq���邱�Ƃ����҂���܂��B�v���X�����[�X��������i�p��Łj ��������i���{��Łj �����������i����T�C�g�j �ł��B �Љ�L�������{�̌���.com �A�����H�ƐV�� �AMed IT Iech �AEurekAlert! �APhotonics.com �AScienceDaily �AFLORIDA News Times �AIntresting Engineeering �A���o�o�C�I�e�N �Ɍf�ڂ���܂����B
2021�N3��25��
Catalytic photooxygenation degrades brain A�� in vivo. Nozomu Nagashima, Shuta Ozawa, Masahiro Furuta, Miku Oi, Yukiko Hori, Taisuke Tomita, Youhei Sohma and Motomu Kanai Science Advances 7(13): eabc9750, 2021. doi: 10.1126/sciadv.abc9750.
�A���c�n�C�}�[�a�iAD�j���ǂ̌����̈�Ƃ��āAamyloid �� peptide�iA���j���ُ�ɋÏW���ăA�~���C�h���`�����A�]���ɒ~�ς��邱�Ƃ��������܂��B��X�́A����܂œ����L�@�������w�����̋��䋁�����A���n�m���O���[�v���[�_�[�Ƌ��ɁA���ɂ���Ċ�����������_�f���G�}��p���āA�ÏW����A���ɑ��Ď_�f�C����t�������@���J�����A����ɂ����A���̌����I�ȏ������\�ł��邱�Ƃ����o���Ă��܂����B�{�����ł́A���̎�@�����Ö@�Ƃ��ĉ��p���邽�߂ɁA�]�ڍs���̍����V���ȐG�}���J�����A�G�}�̐Ö����^�Ɠ��W���O����̌��Ǝ˂Ƃ�����N�P�I�ȕ��@�ŁAAD���f���}�E�X�]���̒~��A���ɑ��đI��I�Ɏ_�f��t�����邱�Ƃɐ������܂����B���̔�N�P�I�_�f���������Ԍp������ƁAAD���f���}�E�X�]���̒~��A���ʂ������ł��邱�Ƃ����炩�ɂ��܂����B���̌��ʂ́A����A����I�ȐV�KAD���Ö@�̑n�o�Ɍq���邱�Ƃ����҂���܂��B�v���X�����[�X�������� �ł��B�Љ�L�������{�̌���.com �A���o�o�C�I�e�N �Ɍf�ڂ���܂����B
2020�N9��1��
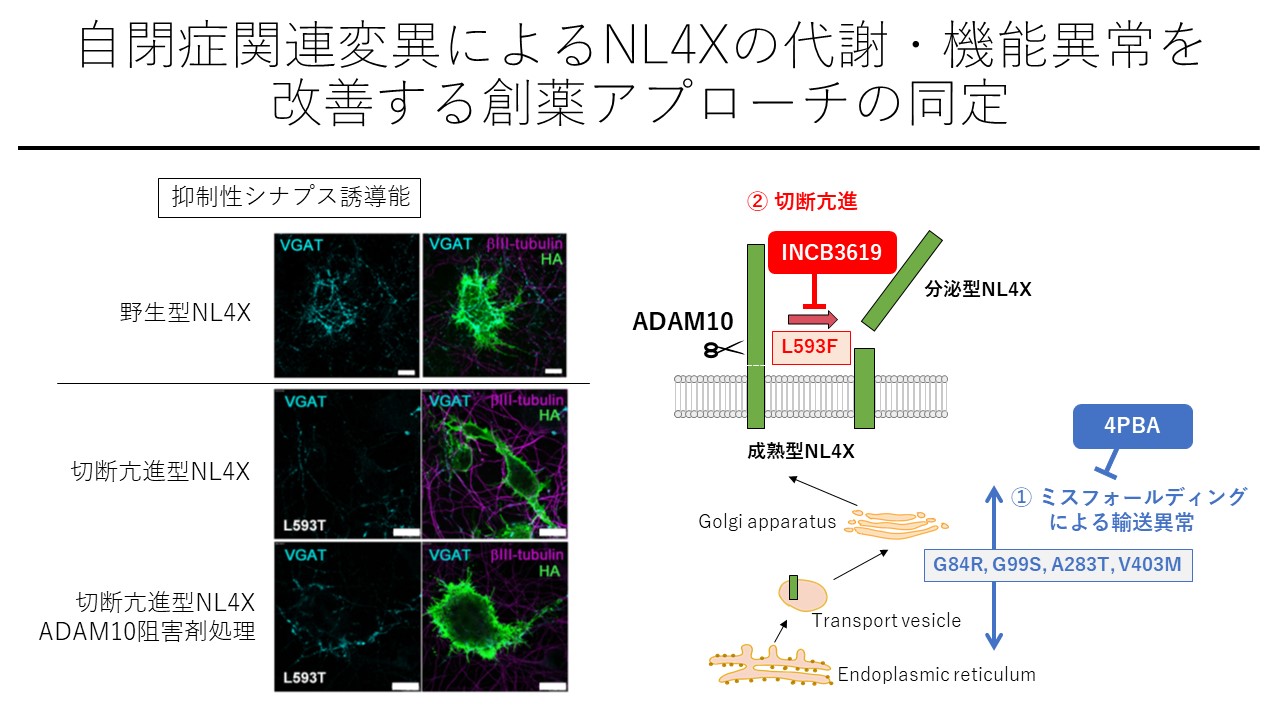
Autism-associated variants of neuroligin 4X impair synaptogenic activity by various molecular mechanisms Takafumi Yumoto, Misaki Kimura, Ryota Nagatomo, Tsukika Sato, Shun Utsunomiya, Natsue Aoki, Motoji Kitaura, Koji Takahashi, Hiroshi Takemoto, Hirotaka Watanabe, Hideyuki Okano, Fumiaki Yoshida, Yosuke Nao and Taisuke Tomita Molecular Autism 11, Article number: 68 (2020), doi:doi.org/10.1186/s13229-020-00373-y
Neuroligin�̓V�i�v�X�I�[�K�i�C�U�[�Ƃ��Ēm����ڒ����q�t�@�~���[�ł���A�_�o�זE�ԃV�i�v�X�̌`����ێ��Ɋւ���Ă��܂��BX���F�̏�ɑ��݂���NLGN4X ��`�q�ɃR�[�h�����NL4X�̓q�g���ٓI��Neuroligin�ł���A���NJ��҂�_�x�؊��҂ɂ����ăi���Z���X�ψق�����������Ă��邱�Ƃ���ANL4X�ɂ��V�i�v�X�`���\�̒ቺ�������̎������ǃ��J�j�Y���Ɋւ�邱�Ƃ���������Ă��܂��B����ANLGN4X ��`�q��ɂ͗l�X�ȃ~�X�Z���X�ψق�����������Ă��܂��B�����̕ψق�NL4X�̑�ӂƋ@�\�ɂǂ̂悤�ȉe�����y�ڂ����ɂ��đ̌n�I�ɉ�͂��A���E�̂ɂ�����t�H�[���f�B���O�ُ�������N�����^�C�v�ƁA�זE�\�ʖ���ł̃^���p�N�����i�V�F�f�B���O�j�i������^�C�v�̕ψق����邱�Ƃ����o���܂����B�����Ă��ꂼ��t�H�[���f�B���O���������܂�A�V�F�f�B���O�j�Q�܂ɂ����NL4X�̃V�i�v�X�`���\�����邱�Ƃ����o���A���ǂ�_�x�̎��Âɂ������`�q�^�f�f�Ɋ�Â���������Ẩ\������܂����B�{�����͓������ȎY�w�A�g�����������i����`�j�ƁA�c���w��w���Ƃ̋��������ōs���܂����B
2020�N4��20��
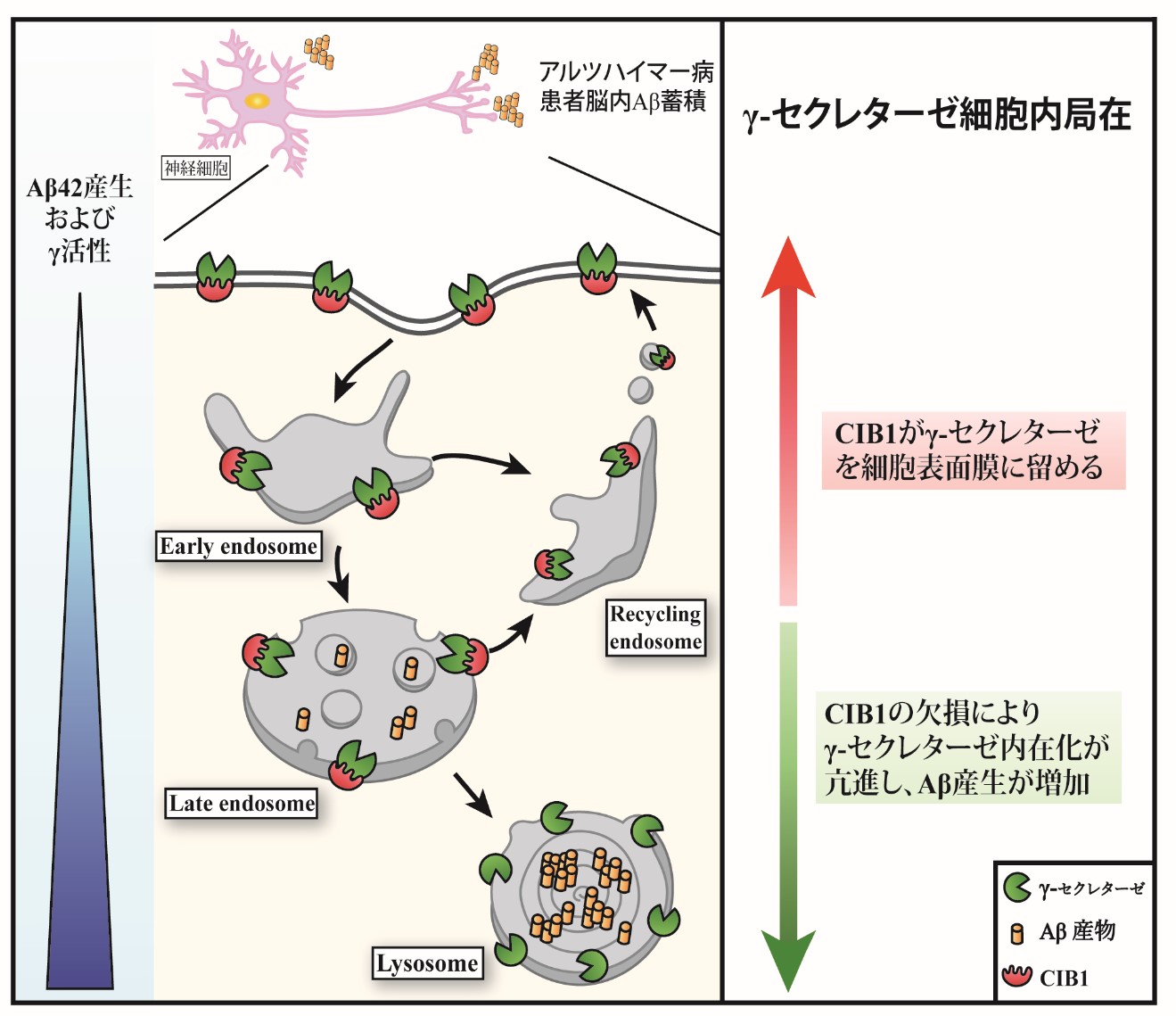
Identification of calcium and integrin-binding protein 1 as a novel regulator of production of Amyloid �� peptide using CRISPR/Cas9-based screening system Yung Wen Chiu, Yukiko Hori, Ihori Ebinuma, Haruaki Sato, Norikazu Hara, Takeshi Ikeuchi and Taisuke Tomita FASEB Journal: April 20, 2020, doi:10.1096/fj.201902966RR
�A���c�n�C�}�[�a�iAD�j�ɓ����I�ȕa���w�I�����Ƃ��āA�A�~���C�h���y�v�`�h�iA���j�ُ̈�Ȕ]���~�ς��������܂��BA���́A�O��̃^���p�N��APP������ƃ��Z�N���^�[�[�ɂ���ē�i�K�̐ؒf�������Y������܂��BA���̋ÏW�E�~�ς�AD���ǂ̍ŏ����ɐ����A�����Đ_�o�זE���Ƀ^�E�̋ÏW�E�~�ς������N�����Đ_�o�ϐ��Ɏ��邱�Ƃ���������Ă��܂��B���������̍ŏ����ߒ��ł���A���Y���Ɋւ���ڍׂȃ��J�j�Y���͖������炩�ɂȂ��Ă��炸�A���{�I���Ö@���m������Ă��܂���B�{�����ł́A�Q�m���ҏW�Z�p�ł���CRISPR/Cas9�V�X�e����p���āAA���Y������Ɋւ��V�K���qcalcium and integrin-binding protein 1�iCIB1�j�̓���Ƃ��̎Y�����䃁�J�j�Y���𖾂炩�ɂ��܂����BCIB1�̌����ɂ��A���Y�����㏸���܂����B�܂�CIB1�����ʂ̌����́A���Z�N���^�[�[�̑��ʂɂ͉e����^���Ȃ�����ŁA���Z�N���^�[�[�̍זE�\�ʖ��̑��ݗʂ����������܂����B���������̐�s��������A���Z�N���^�[�[�̍זE���Ǎݕ��ʂɂ����A���Y���ʂ��ϓ����邱�Ƃ��킩���Ă��܂��B���Ȃ킿�{�����́ACIB1�����ʂ̌����ɂ���ă��Z�N���^�[�[�̓��݉������i���邱�Ƃ�A���Y������������ƍl�����܂��B����ɏ���AD���Ҕ]�ɂ�����CIB1�����ʂ̒ቺ���F�߂��܂����B���̂��Ƃ́A�����ɋN����CIB1�̕ϗe��AD���ǂɊ�^���邱�Ƃ��������Ă���ƍl�����܂��B
����A����CIB1��W�I�Ƃ����V����AD���ÁE�\�h�헪�̒A�����f�f�@�̊J���Ɍq���邱�Ƃ����҂���܂��B�{�����͐V����w�]�������Ƃ̋��������ōs���܂����B�v���X�����[�X�������� �������� �ł��B�Љ�L�������{�̌���.com �A���o�V���E�F�u�T�C�g �AQLife Pro �ABioSpace �AScienceDaily �AMedical Xpress �AUsAgainstAlzheimer's�T�C�g �ACitizenSide�i�t�����X��T�C�g�j �Ɍf�ڂ���܂����B
�X�^�b�t
�x�c�@�ו�
Taisuke Tomita
����
��w��������
�ɓ��@����
Genta Ito
��w��������
��w�@���m����ے�
Liu Yanchen
Yanchen Liu
3�N�i��Ȋw�H�j
��w�@�C�m�ے�
�����@��l
Reito Nakamura
2�N
�w����
�����@�L
Yutaka Tatenuma
6�N�i��w�j
�ߋ��̃����o�[�Əo����
2021�N 2020�N 2019�N 2018�N 2017�N 2016�N 2015�N