研究方針
基本的な方向性は、「神経精神疾患の分子・細胞病態解明と介入法の研究」です。また主たる対象疾患はアルツハイマー病、自閉症、パーキンソン病です。しかし以下の各テーマは完全に独立したものではなく、疾患の治療法、介入法の開発の上でもお互いに関連し合うものです。またそれぞれの視点では気づかないようなことも、他の人の目から見ることで新しい発見も産まれます。その上でも、ラボメンバーの間では常に”open minded, data sharing”であるべきだと考えています。
それぞれの項目に記載されている英文総説についてPDFをご希望される方は、富田までメールにてご連絡をお願いします。
Aβ代謝メカニズム(産生、分泌、分解)とその制御の研究
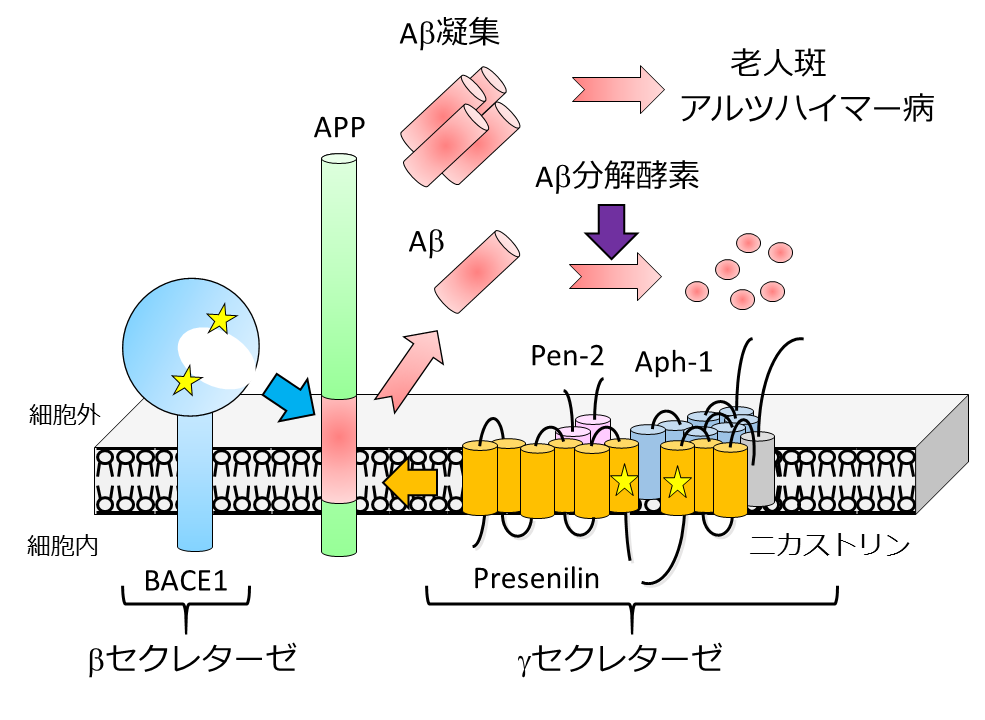
老人斑の主要構成成分であるAβは前駆体タンパク質APPがβおよびγセクレターゼによって切断を受けて分泌されます。その産生機構や分解機構の異常はアルツハイマー病発症リスクに直結することが明らかとなっています。
我々はこれまで、主にγセクレターゼに着目しその活性制御法の開発を行うと同時に、「膜内配列切断酵素」として新しいプロテアーゼの定義を打ち立てるに至りました。またアストロサイトがAβ分解酵素KLK7を放出し脳内のAβ量を制御していることも見出しました。このようにAβ代謝メカニズムの全容を明らかにし、その制御機構を解明することで、アルツハイマー病治療薬や診断薬の開発につながると考えています。
γセクレターゼによる膜内配列を切断するメカニズムに関する総説はこちらです。
APPおよびAβ産生に関連するプロテアーゼに関する総説はこちらです。
細胞内小胞輸送とAβ産生に関する総説はこちらです。
Aβ蓄積後に生じる細胞病態の理解と診断法開発
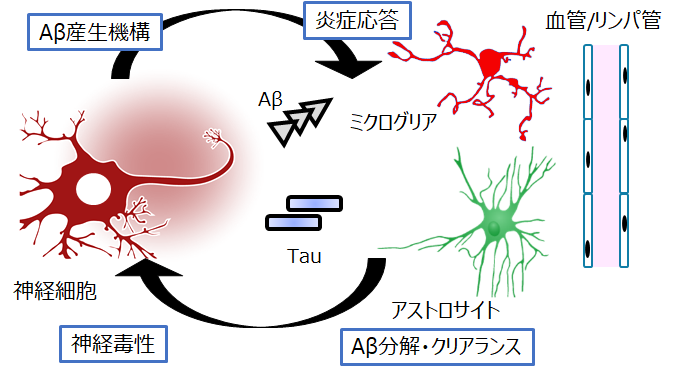
大規模観察研究の結果から、Aβ蓄積はアルツハイマー病発症の10〜20年以上前から生じていることが示されています。そのため、発症前に脳内のAβ蓄積を検出し、将来のアルツハイマー病発症リスクを見積もる方法が求められています。
このAβ蓄積の後に脳内で起こる慢性的な変化は、神経細胞のみではなく、グリア細胞、血管系など様々な細胞が影響を受けていることが明らかとなっています。そこでこれら凝集タンパク質が蓄積した後に生じる、個々の細胞のレスポンスと慢性化に伴う変化を細胞病態「Cellular pathology」として捉え、その全容解明を目指します。また最近同定された血液バイオマーカーについても、その産生機構の解明を目指します。
アストロサイトとアミロイド蓄積病態に関する総説はこちらです。
患者脳に蓄積するアミロイド形成機構解明と制御
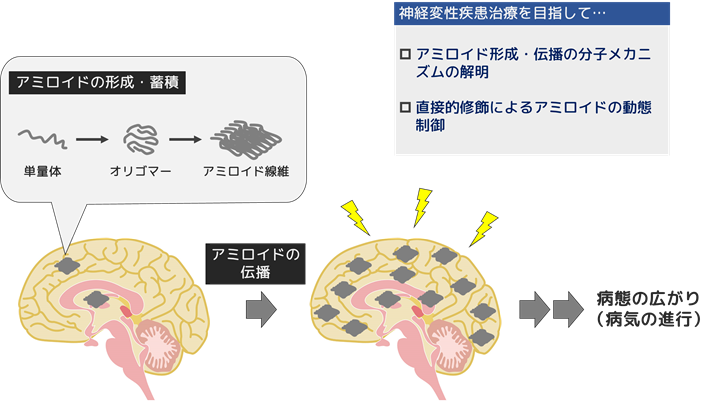
アルツハイマー病、前頭側頭型認知症、パーキンソン病などの多くの神経変性疾患に共通する特徴的な病理は、タンパク質が異常な線維状構造をとった「アミロイド」と呼ばれる線維の形成・蓄積です。アミロイドを形成するタンパク質は様々で、その形成・蓄積部位も細胞外/細胞内、神経細胞/グリア細胞と様々ですが、家族性疾患研究からいずれもアミロイドの形成が疾患発症の原因と考えられています。このことから、アミロイド形成やその広がりを制御することが神経変性疾患の治療戦略として重要と考えられます。
アミロイド形成機構、アミロイド蓄積病理の広がりの機構(細胞間伝播機構)を分子レベルで解明し、病態形成メカニズムを明らかにすることを目的に研究を行っています。さらに有機合成化学研究室と共同で、アミロイドの直接的酸素修飾による動態制御研究を展開し、画期的な神経変性疾患治療法の開発を目指しています。
アミロイドβの光酸素化に関する総説はこちらです。
光酸素化触媒に関する総説はこちらです。
アルツハイマー病におけるミクログリアの病的機能解明
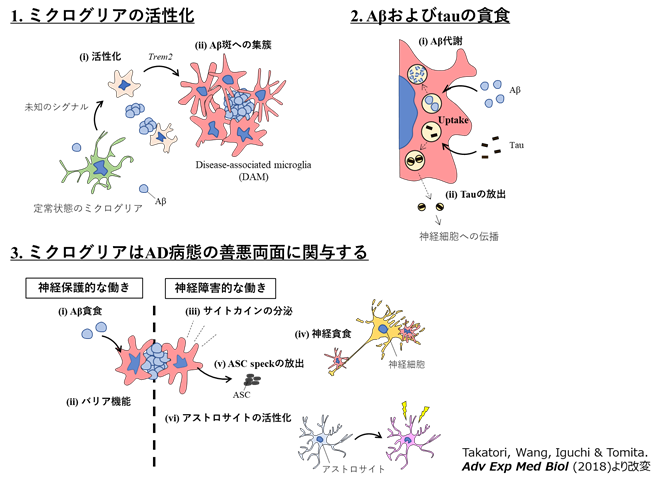
近年、TREM2をはじめ、ミクログリアに特異的に発現する複数の遺伝子について、アルツハイマー病の発症リスクと関連した遺伝子多型が見出されてきました。またミクログリアは自閉症スペクトラム障害など多くの精神神経疾患の病態に関与することが指摘されています。したがってミクログリアは複数の疾患に対して有効な創薬標的細胞となる可能性があります。
一方、脳内の免疫担当細胞であるミクログリアが周辺環境の変化に応答するメカニズムも不明な点が多く残されています。私たちは疾患の研究を通してミクログリアの情報処理のメカニズムにも迫るべく、疾患モデルマウスを用いたin vivo解析を含め、光顕・電顕でのイメージング手法など様々な技術を応用し研究を行っています。
アルツハイマー病リスク因子に関する総説はこちらです。
アルツハイマー病タウ病態の再現
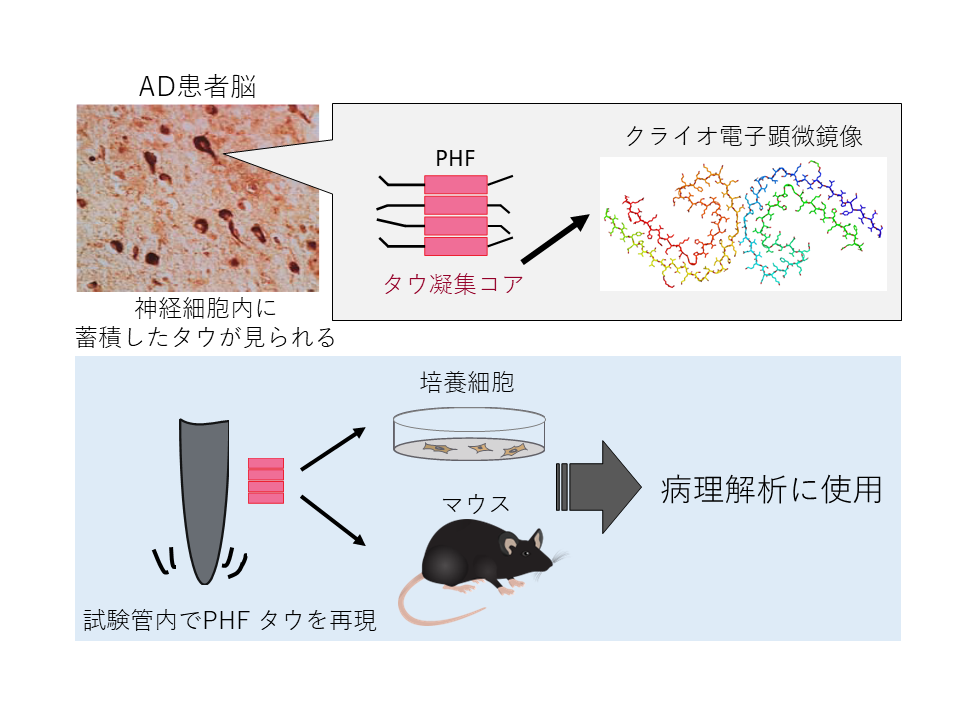
アルツハイマー病の解明に向けて、ヒトの病理に近い動物モデルを用いた研究が望まれます。近年のクラオ電子顕微鏡解析の技術革新により、患者脳に蓄積する異常タンパク質の構造が解明されてきました。そしてタウについては疾患ごとに構造多型が存在していること、in vitroで形成させたタウ線維はこれら患者脳に蓄積しているタウ線維とは異なる構造をしていることが明らかとなりました。そのため、各タウオパチー患者脳に蓄積しているタウ線維を再現する必要性が想定されています。
そこで我々は神経細胞内で蓄積するタウタンパク質の構造情報をもとに、神経原線維変化(PHF)構成モデルを培養細胞、そしてマウスにて再現を試みています。これらの研究を通じて、ヒト病理を再現し創薬研究に利用できるモデルを確立すると同時に、それぞれ異なるタウオパチーの特異性を決定するメカニズムを明らかにします。
アルツハイマー病モデルマウスに関する総説はこちらです。
パーキンソン病の分子病態メカニズム解明
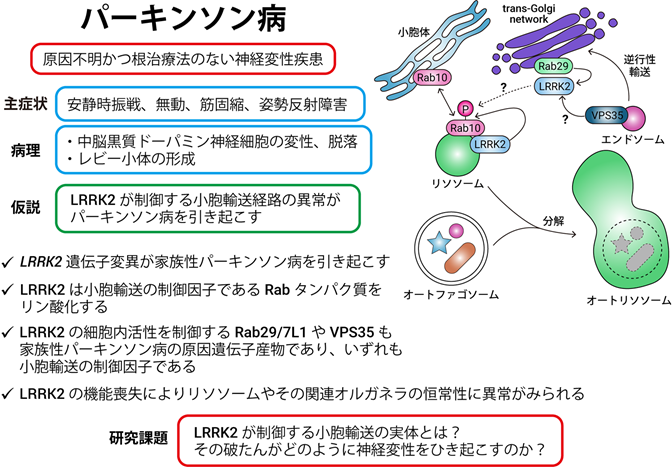
近年、様々な遺伝子変異が家族性パーキンソン病の原因となることが明らかになり、そのなかでも当研究室では特にLRRK2と呼ばれるキナーゼに着目して研究を進めています。LRRK2が小胞輸送制御因子であるRabファミリーに属するいくつかのタンパク質を生体内でリン酸化すること、また複数の小胞輸送関連分子にパーキンソン病の原因となる遺伝子変異が同定されていることから、細胞内小胞輸送の異常がパーキンソン病の原因となっている可能性が考えられています。
当研究室では、LRRK2によるRabリン酸化の生理的・病的機能や、その制御機構を生化学、分子細胞生物学的手法により解析することを中心とし、パーキンソン病の分子病態における小胞輸送異常の位置づけの解明と、分子メカニズムに基づいた画期的なパーキンソン病治療薬および診断薬の開発を目指した研究を展開しています。
LRRK2とパーキンソン病に関する総説はこちらです。
αシヌクレイン蓄積病態伝播機構の解明

神経変性疾患において特徴的な異常タンパク質凝集体がプリオン様性質をもち、細胞間を伝播することによって脳内に拡大する可能性が示されています。特にパーキンソン病や多系統萎縮症患者脳において蓄積しているαシヌクレインについては、リコンビナントαシヌクレイン線維や、患者脳由来の異常型αシヌクレインが凝集核(シード)となり、プリオン様伝播を引き起こすことが試験管、培養細胞、動物モデルで実証されています。
そこでこれらの疾患の発症及び進行機序の解明を目指し、現在確立されているプリオン様伝播実験モデルを用いて凝集体形成及び伝播のメカニズムや患者脳に蓄積した異常型タンパク質凝集体のプリオン様性質に関する研究を行っています。
これまでに進めてきたアルツハイマー病とセクレターゼの研究から学んだ、膜タンパク質代謝の異常が疾患を引き起こすという事実と、その代謝システムの制御法が開発できるという事実を踏まえて、神経細胞シナプス接着分子の代謝経路の解明とその制御法の開発から、自閉症を含めた精神疾患へ新しい創薬アプローチが出来るのではないかと考えて研究を進めています。
認知症予防運動プログラムの開発
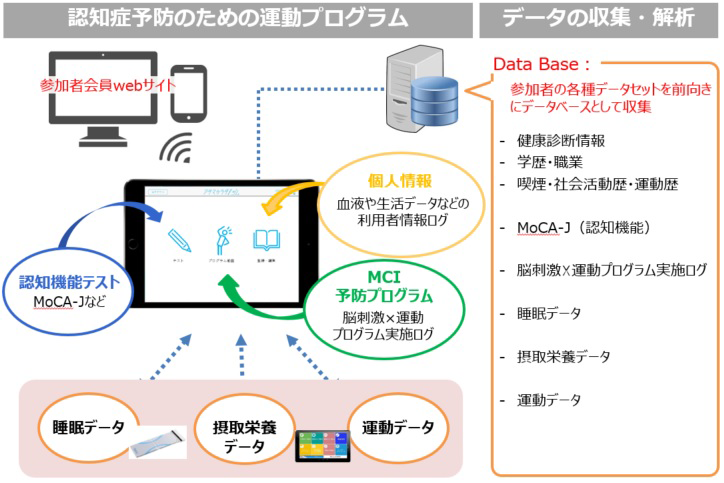
医療費問題を踏まえた上で認知症の未発症期への介入を考えると、薬物以外の方法での認知症予防法の開発が強く求められています。近年、運動が認知機能の低下や認知症の予防に繋がる可能性があるという報告が相次いでいます。そこで複数の企業と認知症予防に寄与する運動プログラムの共同開発を進めています。
開発したプログラム実施と並行して、認知機能及びその他認知症発症に関連する可能性のある生化学パラメータ、食事や睡眠等の生活習慣に関する情報を蓄積、解析します。そして本質的な疾病予防に寄与するプログラムへの精度向上につながる知見の獲得を目指しています。
本運動プログラムに関する新聞掲載記事はこちらです。