News & Topics
研究室について
私達は主に生化学と分子生物学を用いて、培養細胞と動物モデルの両面から分子・細胞病態研究を進め、新しい技術と新しい創薬標的を同定し、治療薬開発へつながる成果を世界に発信すると同時に、基礎生物学研究に新たな展開を与えることを目標としています。また産学との共同研究を積極的に進め、研究成果の社会実装を目指しています。
研究内容についてはResearchをご覧ください。また薬学部3年生向けの教室紹介スライドをAbout Usに掲載しています。
篤志家の皆様へのご寄附のお願いについてはこちらを御覧ください。
2024.9.6-7
第29回日本病態プロテアーゼ学会学術集会を東京大学薬学部講堂において開催いたしました。詳細についてはこちらをご覧ください。

また宋家禎大学院生、富澤郁美大学院生がYoung Investigator Awardを、中吉理恵大学院生、栗山摩衣大学院生、小林穗乃可大学院生がBest Student Presentation Awardを受賞しました!
学術集会の様子についてのPhotoアルバムはこちら
2024.6.22
東京で開催されたBIOUTにおいて山根大典大学院生が優秀ポスター発表賞を受賞しました。
2024.6.15
東京で開催された生化学会関東支部会例会において長瀬竜也大学院生(口頭部門)、小林広人大学院生(ポスター部門)が優秀発表賞を受賞しました。
2024.6.14
佐藤千尋先生(ワシントン大学セントルイス校)のセミナーが開催されました。詳細についてはこちらをご覧ください。
2024.5.29
韓国で開催されたISMND2024において宋家禎大学院生がISMND Travel Fellowshipを 受賞しました。
2024.5.9
惠谷隼人元学部生、王文博元大学院生、赤堀愛果大学院生、高鳥翔助教による論文"Selective agonism of GPR34 stimulates microglial uptake and clearance of amyloid β fibrils"をbioRxivに発表しました。なお本研究は衛生化学教室、薬化学教室との共同研究成果です。
2024.4.30
堀由起子准教授による論文"Leuco Ethyl Violet as Self-Activating Prodrug Photocatalyst for In Vivo Amyloid-Selective Oxygenation."がアクセプトされました。なお本研究は有機合成化学教室との共同研究成果です。
2024.4.1
2024年度、当教室に新たに7名の学生が増えました。神経変性疾患の理解につながる分子及び細胞病態研究、そして新しい基礎生物学の開拓を目指していきます。そして新たな治療モダリティの開発、予防法の創出、またリアルワールドデータの利活用などの取り組みを継続し、社会実装に向けていきたいと考えています。なお2023年度の出来事についてはこちらをご覧ください。
最近の研究から
2023年11月1日
新しい論文をFASEB Jに発表しました
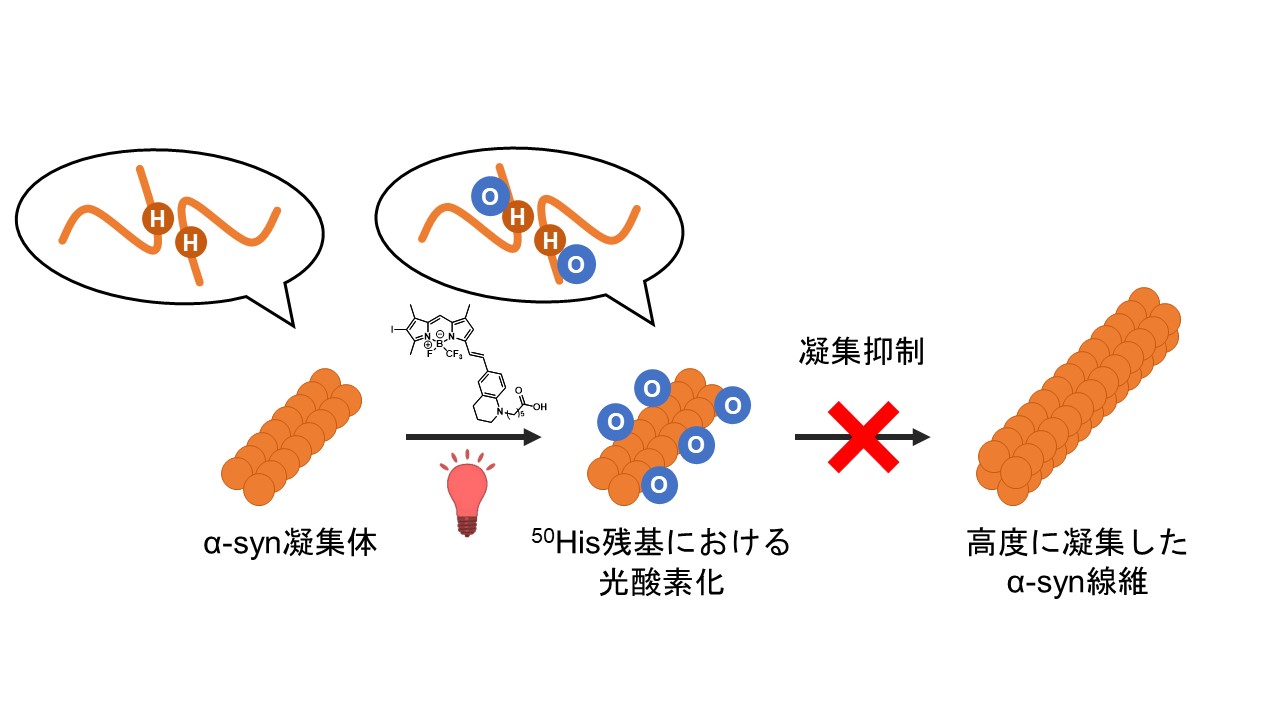
パーキンソン病やレビー小体型認知症、多系統萎縮症などの神経変性疾患は、脳内におけるα-シヌクレイン(α-syn)の凝集蓄積を発症原因とする疾患群であり、シヌクレイノパチーと総称されます。これまでの研究で、我々は東大薬有機合成化学教室の金井求教授、和歌山県立医科大学の相馬洋平教授と共に、光によって活性化される光酸素化触媒を開発し、α-syn凝集体への酸素原子がα-synの凝集を抑制することを明らかにしてきました(2023年4月17日発表論文参照)。本研究では、α-synの50番目のヒスチジン残基(50His)への酸素付加が、光酸素化によるα-syn凝集体の凝集抑制に重要な役割を果たすことを明らかにしました。また、50Hisにおける光酸素化は培養細胞内でもα-synの凝集を抑制しました。さらにシヌクレイノパチー患者脳由来のα-syn凝集体も光酸素化が可能であったことから、今後、新規シヌクレイノパチー治療法の創出につながることが期待されます。
2023年4月17日
新しい論文をChem Commに発表しました
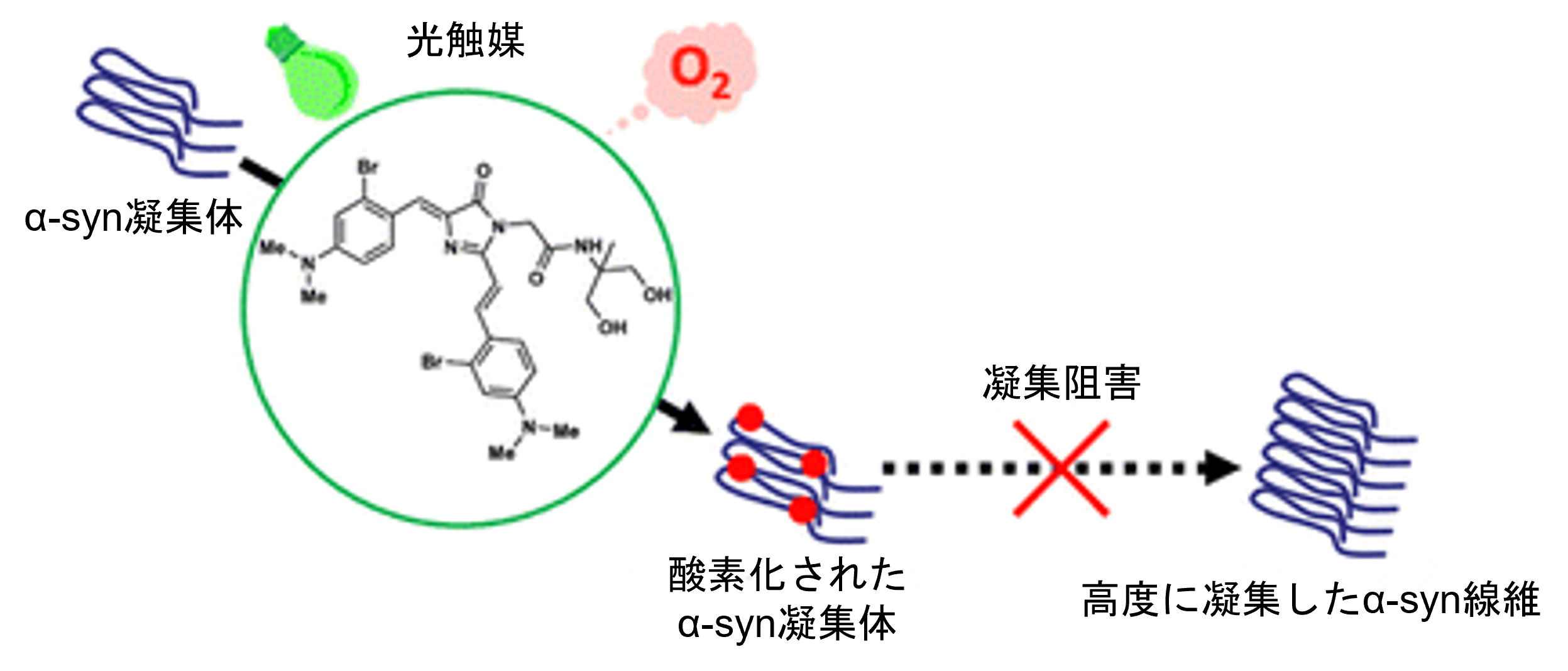
パーキンソン病やレビー小体型認知症、多系統萎縮症など、シヌクレイノパチーと総称される神経変性疾患群に共通の病理学的特徴として、脳内におけるα-シヌクレイン(α-syn)の凝集蓄積が挙げられます。我々はこれまで、東大薬有機合成化学教室の金井求教授、和歌山県立医科大学の相馬洋平教授と共に、光によって活性化される光酸素化触媒を用いた光酸素化法を開発し、α-synと同様に、アルツハイマー病において凝集蓄積するAβやタウに対して適用してきました。本研究では、新規触媒を開発して光酸素化法をα-synに対して適用し、光酸素化がα-synの凝集を抑制することを見出しました。また本触媒は、比較的分子量が小さく神経毒性が高いと言われているα-synオリゴマーに対しても効率的に酸素化が可能であることが明らかになりました。これらの研究結果から、光酸素化法がアルツハイマー病だけでなくシヌクレイノパチーの治療戦略にもつながることが期待されます。
2023年4月10日
新しい論文をFASEB Jに発表しました
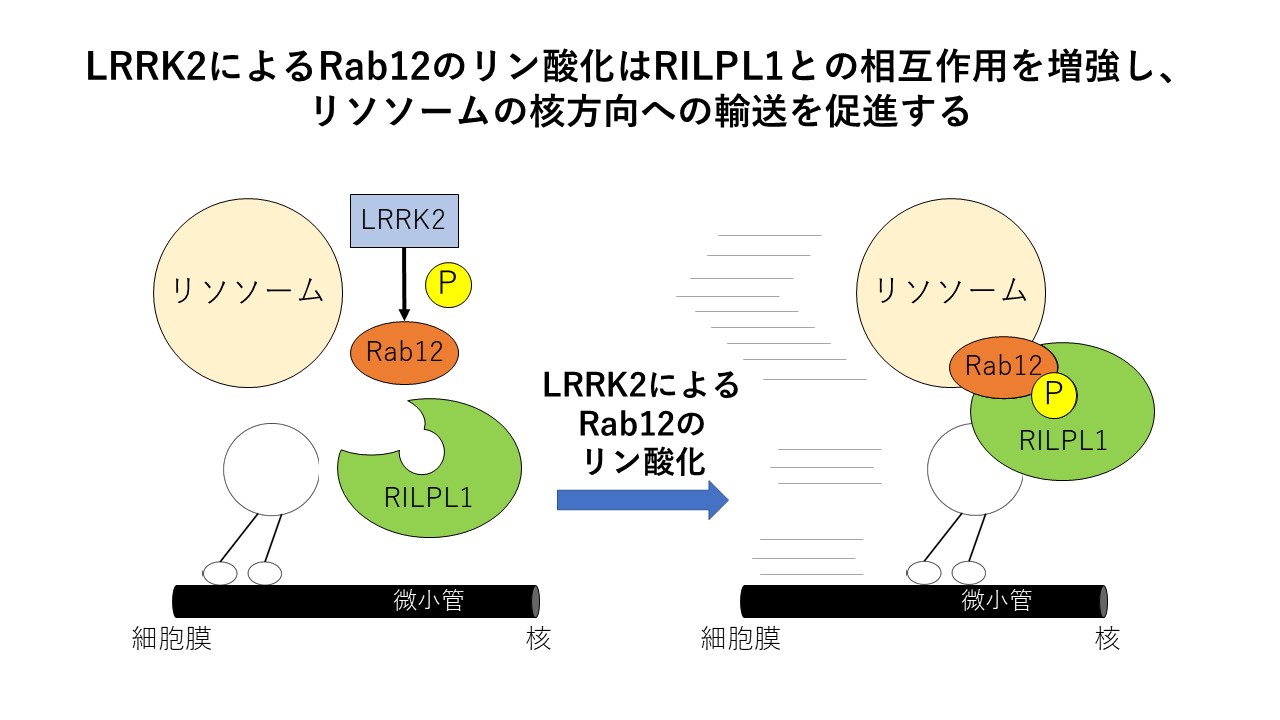
Leucine-rich repeat kinase 2(LRRK2)は、家族性パーキンソン病の原因遺伝子として知られています。先行研究により、LRRK2の基質タンパク質の過剰なリン酸化がパーキンソン病の原因となることが明らかになっていますが、基質の過剰リン酸化により何が生じるのか明らかにされていませんでした。本研究では、培養細胞に活性化型LRRK2を過剰発現すると、細胞内小器官の1つであるリソソームが核近傍に集積することを見出しました。さらなる検討により、LRRK2が基質であるRab12をリン酸化すると、Rab12結合タンパク質であるRILPL1との相互作用が増強され、リソソームの輸送が促進されることを明らかにしました。リソソームの細胞内局在は様々な細胞機能に影響することが近年示唆されており、その新規制御機構を発見した本研究は、生物学的にも興味深いものです。今後、リソソーム局在異常が引き起こす細胞レベルでの影響を明らかにすることで、パーキンソン病の発症に至るメカニズムの全貌解明につながることが期待されます。本研究成果は株式会社HACARUSとの共同研究成果です。
2023年4月7日
新しい論文をNeurosci Resに発表しました
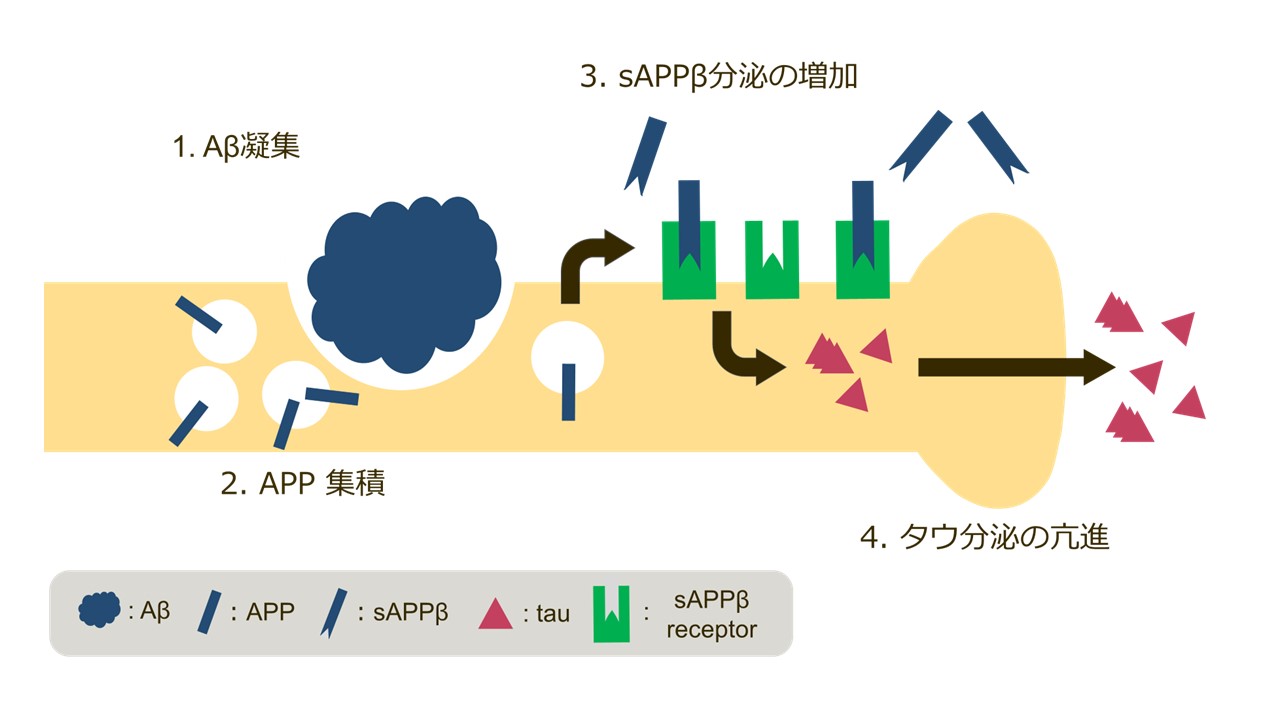
アルツハイマー病(AD)に特徴的な病理学的所見として、アミロイドβペプチド(Aβ)とタウの異常な脳内蓄積が挙げられます。これまでの研究からAβ蓄積が、細胞外に分泌されたタウを介したタウ蓄積病理拡大機構を促進することが示唆されていますが、タウ分泌の正確なメカニズムはわかっていませんでした。そこで、Aβ蓄積の周囲の神経細胞にアミロイド前駆体タンパク質(APP)が蓄積することに着目し、マウス神経芽細胞腫Neuro2a細胞に対してAPPを過剰発現させたところ、タウ分泌が促進されることを明らかにしました。さらに、APP切断産物のうちsAPPβの過剰発現によってもタウ分泌が促進されました。本研究成果は、Aβ蓄積の周囲で起こるAPP蓄積およびその切断亢進がタウ分泌亢進をもたらし、タウ蓄積病理拡大につながることでAD発症に寄与する可能性を示しています。本研究成果は新潟大学脳科学研究所と帝京大学医学部との共同研究で行われました。
2023年4月7日
新しい論文をiScienceに発表しました
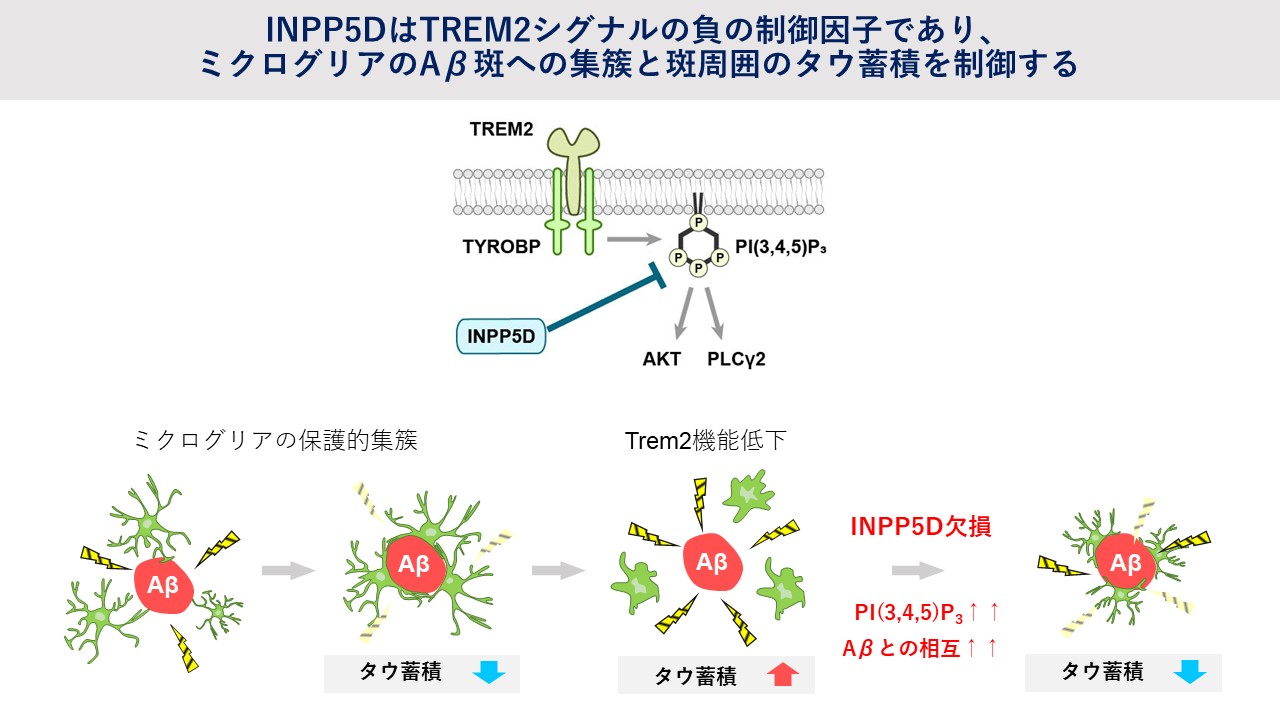
INPP5DはホスホイノシチドPI(3,4,5)P3の代謝酵素であり、中枢ではミクログリアに特異的に発現し、アルツハイマー病(AD)発症リスクとの関連が指摘されています。近年、同じくミクログリアに発現するADリスク遺伝子TREM2の研究が進み、AD発症機序におけるミクログリアの重要性が明らかになりましたが、INPP5Dがどのような機序で発症に関わるのかはよくわかっていません。そこで本研究では、INPP5Dを欠損するADモデルマウスを用いてその病的意義を追究しました。その結果、INPP5D欠損マウスではADの原因物質であるAβに対するミクログリアの応答性が亢進していること、またその機序として、INPP5DがTREM2シグナルを負に制御することを明らかにしました。さらに、INPP5D欠損マウスではAβ周囲においてADの増悪に関与するタウタンパク質の蓄積が減少することも分かりました。本成果は、ミクログリアによるAβ−タウ蓄積病態連関の制御にINPP5Dが重要であることを示唆しており、INPP5D阻害に基づく新たな医薬開発の基礎として重要と考えられます。本研究成果は東京医科歯科大学、東北大学、メイヨークリニック、理化学研究所、名古屋市立大学との共同研究で行われました。
2022年の論文の紹介についてはこちらへ
その他の研究成果についてはこちらへ!