2019年
2019年12月9日
Histidine 131 in presenilin 1 is the pH-sensitive residue that causes the increase in Aβ42 level in acidic pH Tetsuo Cai, Aki Hatano, Kunihiko Kanatsu, Taisuke Tomita
J Biochemistry in press. DOI: 10.1093/jb/mvz110
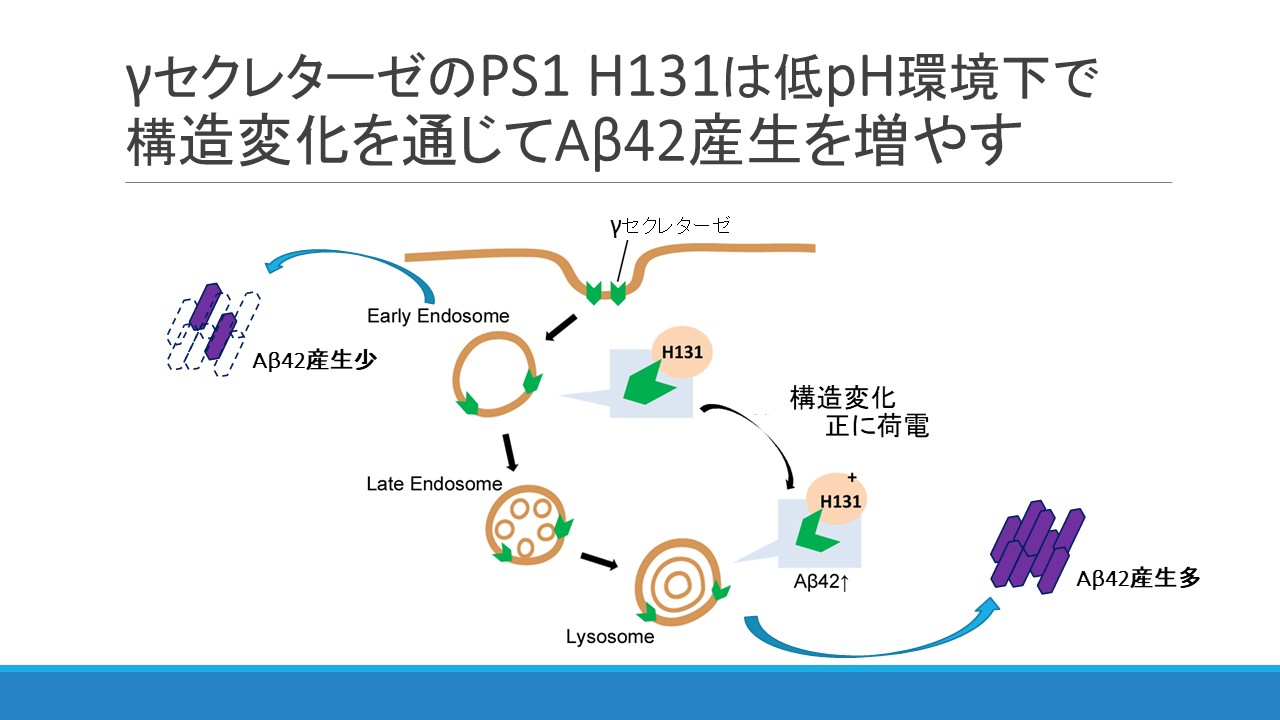
アルツハイマー病の発症に関与するアミロイドβタンパク質(Aβ)は細胞内の局在部位によって産生量が大きく異なり、特に凝集性や毒性の高いAβ42分子種はlate endosomeやlysosomeなど、低pH環境下で産生量が増加することが知られています。本研究では、Aβの産生を担う酵素、γセクレターゼに着目し、γセクレターゼの活性中心サブユニットプレセニリン1 (PS1)のH131残基がpHセンサーとして働いていることを見出しました。このことから、H131のプロトン化がPS1の構造変化を引き起こし、Aβ42の産生を増加させることが示唆されました。本研究室では以前、遺伝学的アルツハイマー病発症予防因子PICALMがコードするCALMタンパク質が、γセクレターゼの細胞内輸送に関わることを明らかにしています。本研究はPS1はCALMタンパク質がAβ42産生を抑制する上で治療ターゲットとなり得ることを支持する研究結果になります。
2019年10月23日
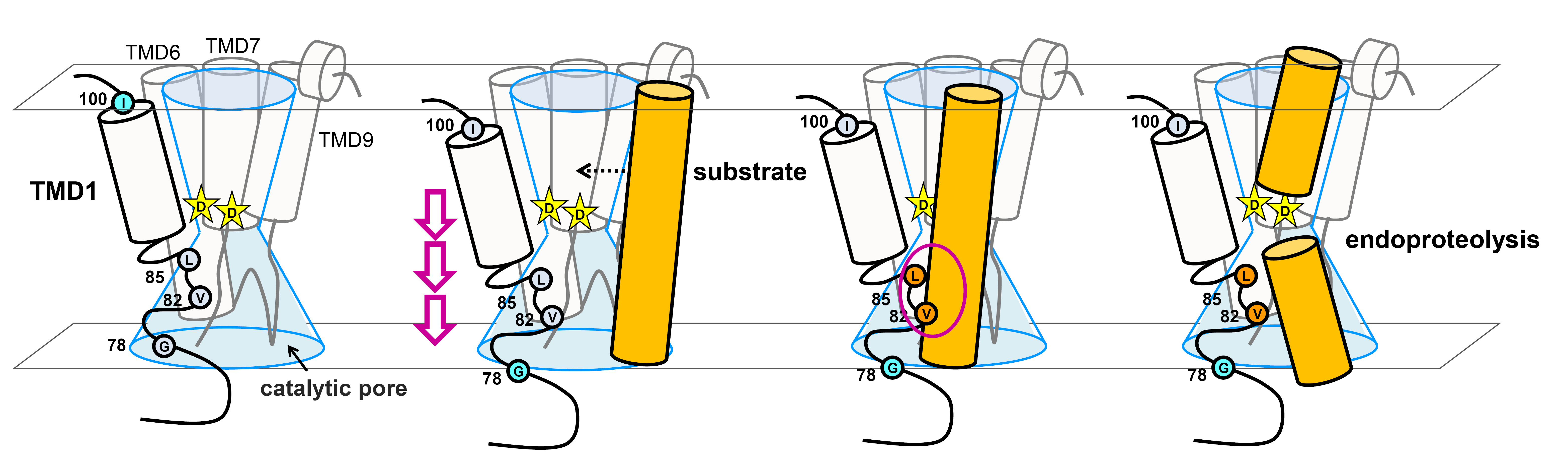
Conformational dynamics of transmembrane domain 3 of presenilin 1 is associated with the trimming activity of γ-secretase Tetsuo Cai, Kanan Morishima, Shizuka Takagi-Niidome, Aya Tominaga, Taisuke Tomita
J Neurosci. 39(43), 8600-8610, 2019. DOI: 10.1523/JNEUROSCI.0838-19.2019
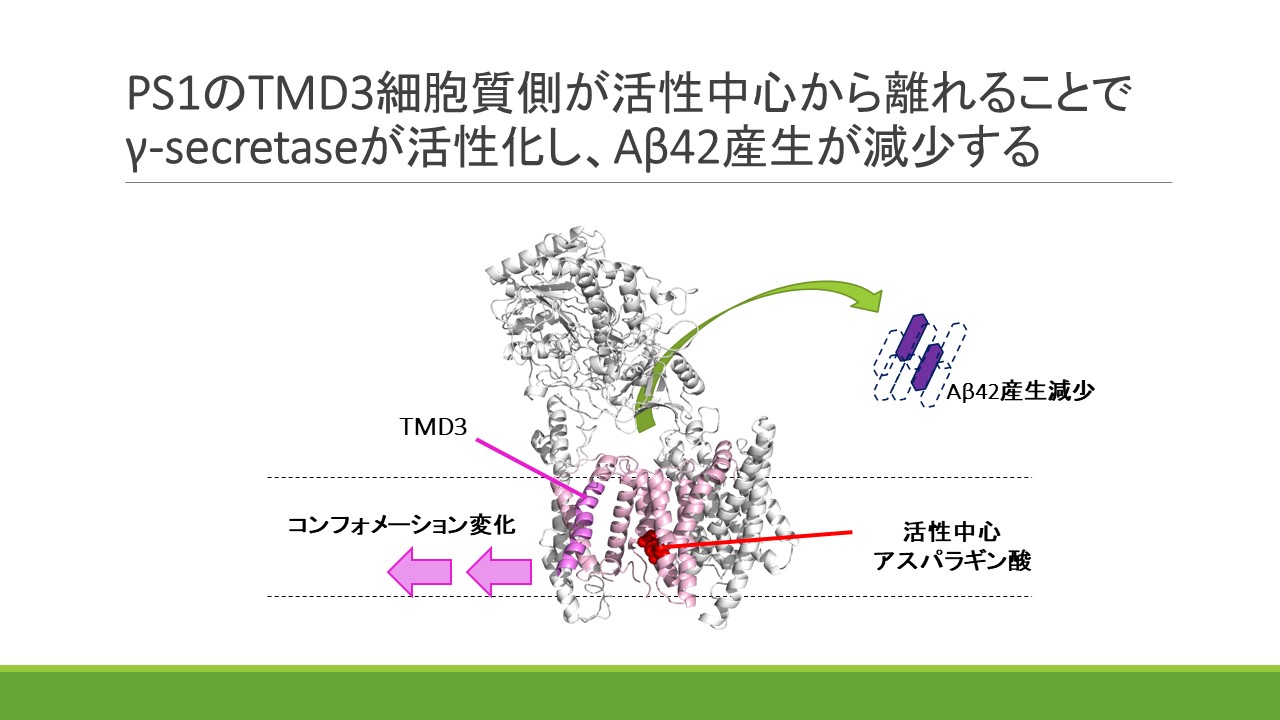
γセクレターゼは膜内配列切断酵素であり、内部の活性中心ポアに基質を取り込んで切断を行います。γセクレターゼによって産生されるアミロイドβタンパク質(Aβ)の中でAβ42種の毒性や凝集性が最も高く、アルツハイマー病発症の原因タンパクとして考えられています。私たちはγセクレターゼの活性中心サブユニットプレセニリン1(PS1)の第3膜貫通領域(TMD3)周辺の活性中心ポアがAβ42産生変動に応じて変化し、特にAβ42産生が低下する時には活性中心ポアが広がることを明らかにしました。更に、この時TMD3の細胞質側が活性中心アスパラギン酸から離れるような動きをすることも発見しました。本成果は世界で初めてPS1のTMD3に着目した構造活性相関解析を行い、Aβ42の産生への関与を明らかにした研究です。
2019年4月26日
Photo-oxygenation inhibits tau amyloid formation Takanobu Suzuki, Yukiko Hori, Taka Sawazaki, Yusuke Shimizu, Yu Nemoto, Atsuhiko Taniguchi, Shuta Ozawa, Youhei Sohma, Motomu Kanai, Taisuke Tomita
Chemical Communications in press. 2019; DOI: https://doi.org/10.1039/C9CC01728C
アルツハイマー病の特徴的な病理学的所見の一つに、タウタンパク質が異常なアミロイドを形成して細胞内に蓄積する神経原線維変化が挙げられます。このタウアミロイドの形成・蓄積とその病理の広がりが認知機能低下と相関することから、その阻害がアルツハイマー病治療戦略の一つと考えられています。これまで私たちは、東大薬学部有機合成化学教室(金井求教授)との共同研究により、アミロイドに対する選択的な酸素原子付加によって、さらなるアミロイド形成を阻害する戦略を見出し、光刺激によって活性化する光酸素化触媒を開発してきました。今回、より酸素化活性の高い新規光酸素化触媒を開発に成功し、in vitroの検討においてタウアミロイドに対して酸素化が可能であること、酸素化によりタウアミロイド形成が阻害されることを明らかにしました。加えて、培養細胞内にタウアミロイドの形成を誘導するモデルにおいても、酸素化によりタウアミロイド形成誘導能が減少することがわかり、タウアミロイドの広がりをも阻害する可能性が示唆されました。本研究成果は、光酸素化触媒を用いたアルツハイマー病に対する新規治療戦略の提示に繋がることが期待されます。プレスリリースはこちら です。紹介記事がUTokyo Focus 、学内広報 2019年6月号(2019.6.28配布)に掲載されました。
2018年
2018年1月8日
Loss of kallikrein‐related peptidase 7 exacerbates amyloid pathology in Alzheimer's disease model mice Kiwami Kidana, Takuya Tatebe, Kaori Ito, Norikazu Hara, Akiyoshi Kakita, Takashi Saito, Sho Takatori, Yasuyoshi Ouchi, Takeshi Ikeuchi, Mitsuhiro Makino, Takaomi C Saido, Masahiro Akishita, Takeshi Iwatsubo, Yukiko Hori, Taisuke Tomita
EMBO Molecular Medicine e8184, 2018; DOI: https://doi.org/10.15252/emmm.201708184
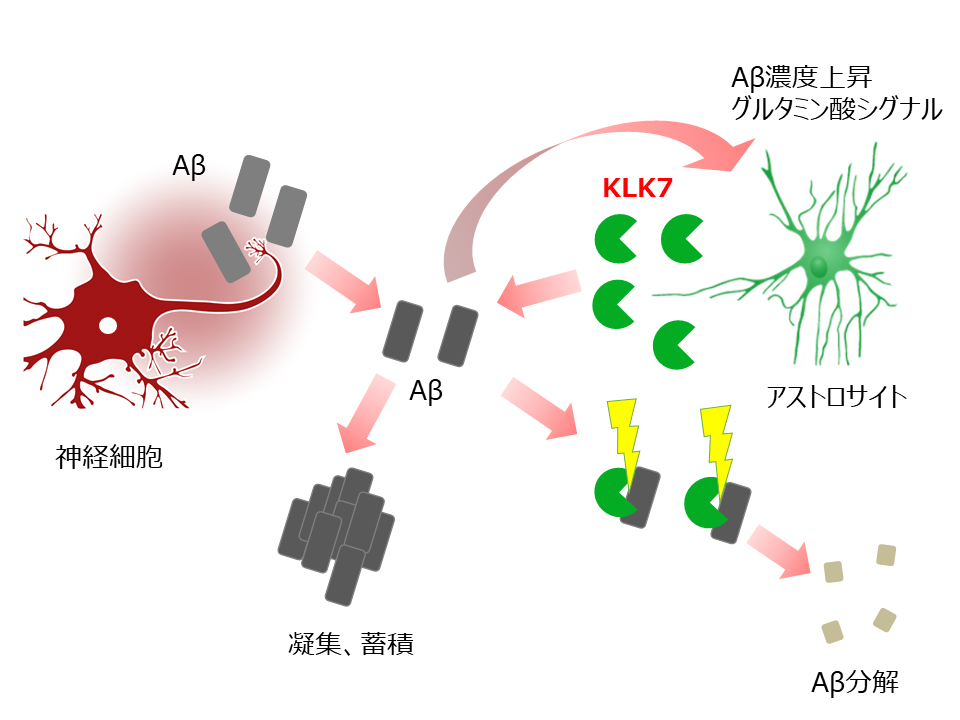
近年、脳に存在する神経細胞以外の細胞のうち、その大部分を占めるグリア細胞の一つ、アストロサイトが、神経機能に対してさまざまな影響を及ぼしていることが注目を浴びています。しかしアルツハイマー病におけるアストロサイトの病的意義については不明な点が多く残されていました。今回、我々はアミロイドβを分解する新規酵素kallikrein-related peptidase 7(KLK7)を同定し、脳内ではアストロサイトが分泌していること、またアルツハイマー病患者脳ではその発現量が低下していること、さらに遺伝子をノックアウトしたモデルマウスにおいてはアミロイドの蓄積が亢進することを明らかにしました。加えて、アストロサイトにおけるグルタミン酸シグナルを抑制することでKLK7の発現量と分解活性を上昇させることができることを見出しました。本研究成果はこれまでにアルツハイマー病発症機構において注目されてこなかったアストロサイトを標的とすることで新規治療・予防薬の開発につながることが期待されます。本研究は東京大学大学院医学系研究科、第一三共株式会社、新潟大学脳研究所、理化学研究所脳科学総合研究センターとの共同研究で行われました。プレスリリースはこちら(東京大学) もしくはこちら(AMED) です。プレスリリースのPDFはこちら です。プレスリリースが日本の研究.com に紹介されました。日経新聞ウェブサイト (2018.1.8)、QLifePro医療ニュース (2018.1.11)、日経バイオテク (2018.1.16)に掲載されました。
2017年
2017年11月3日
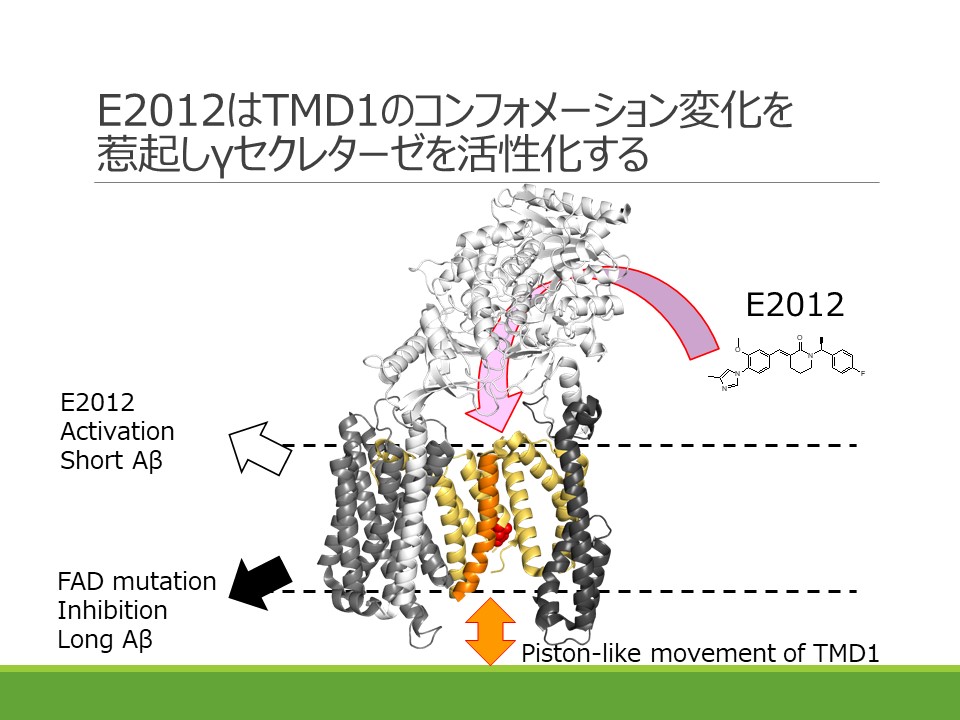
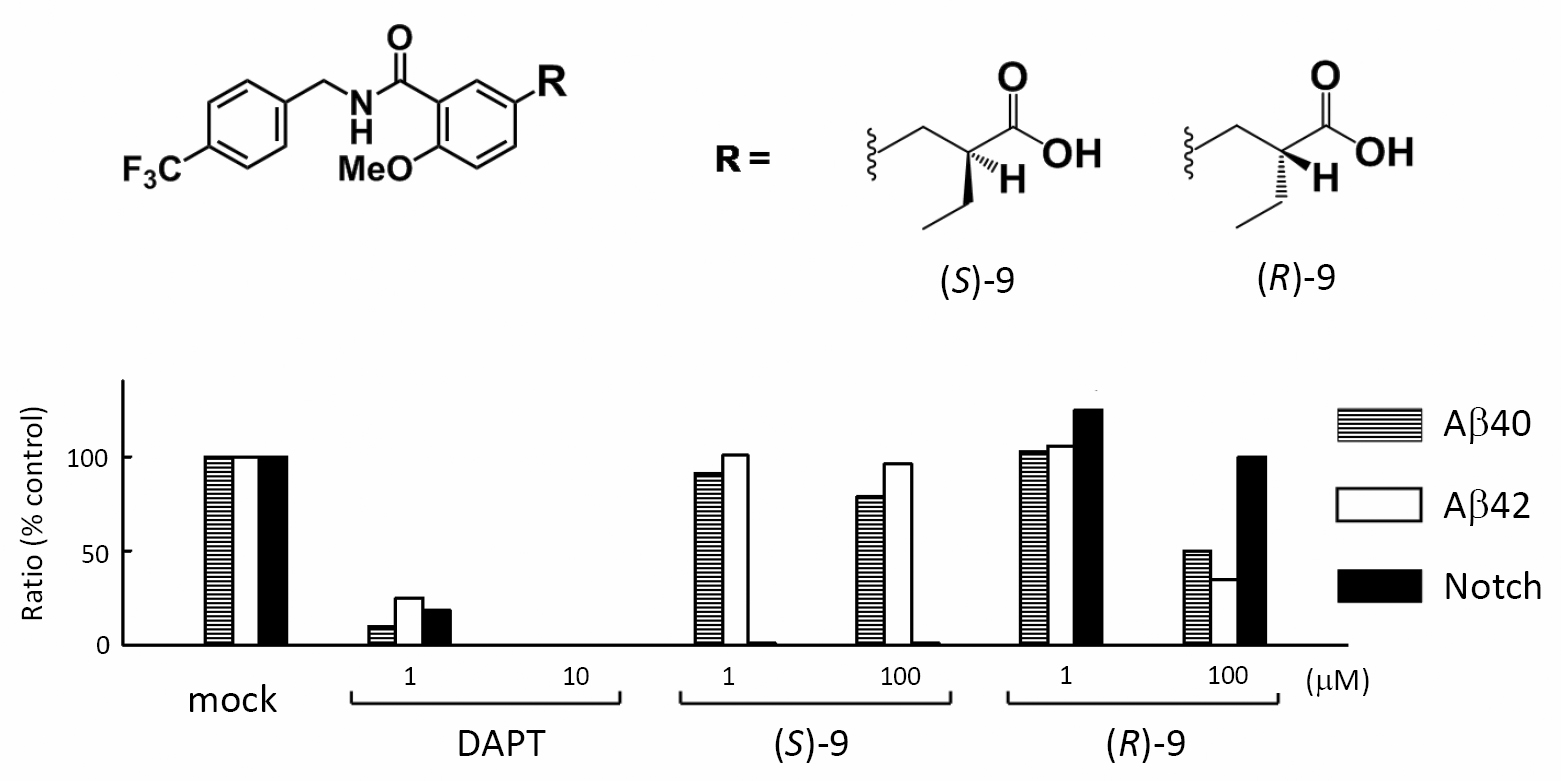
Activation of γ-secretase trimming activity by topological changes of transmembrane domain 1 of presenilin 1 Tetsuo Cai, Masahiro Yonaga and Taisuke Tomita
Journal of Neuroscience 8 November 2017, 1628-17; DOI: https://doi.org/10.1523/JNEUROSCI.1628-17.2017
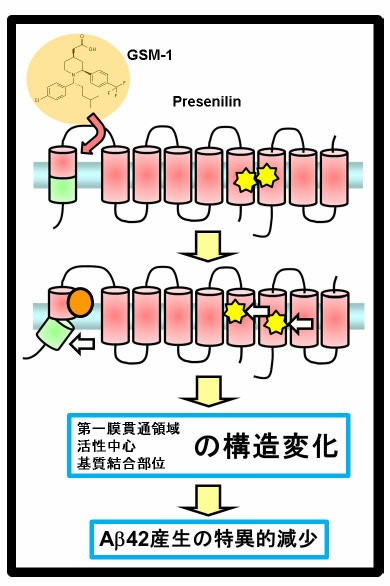
Aβの凝集性や毒性を規定するC末端長を選択的に短くする化合物であるγセクレターゼモジュレーター(γセクレターゼ制御薬、GSM)はアルツハイマー病治療・予防薬候補と考えられています。我々はこれまでにフェニルイミダゾール型GSMが活性中心サブユニットであるPresenilinの第一ループ領域に結合することを明らかとしていました が、今回エーザイ社によって作成、開発されたGSMであるE2012もPresenilinの第一ループ領域を標的領域とすること、更にE2012の相互作用の結果、第一膜貫通領域(TMD1)の膜内位置が上向きに変化することを見出しました。TMD1の膜内位置はγセクレターゼ活性に大きな影響を与えることから(Takagi-Niidome et al., Biochemistry 2010)、GSMがγセクレターゼ活性化薬として機能していることが改めて示され、またGSMのもたらすコンフォメーション変化を世界で初めて明らかにすることができました。本研究はエーザイ株式会社との共同研究の成果です。プレスリリースが日本の研究.com に紹介されました。
2017年4月3日
Two Novel Mutations in the First Transmembrane Domain of Presenilin1 Cause Young-Onset Alzheimer's Disease Collin Y Liu, Yu Ohki, Taisuke Tomita, Satoko Osawa, Bruce R. Reed, William Jagust, Victoria Van Berlo, Lee-Way Jin,
Helena C. Chui, Giovanni Coppola, John M. Ringman
J. Alzheimer Dis. 58(4):1035-1041 (2017) doi: 10.3233/JAD-161203
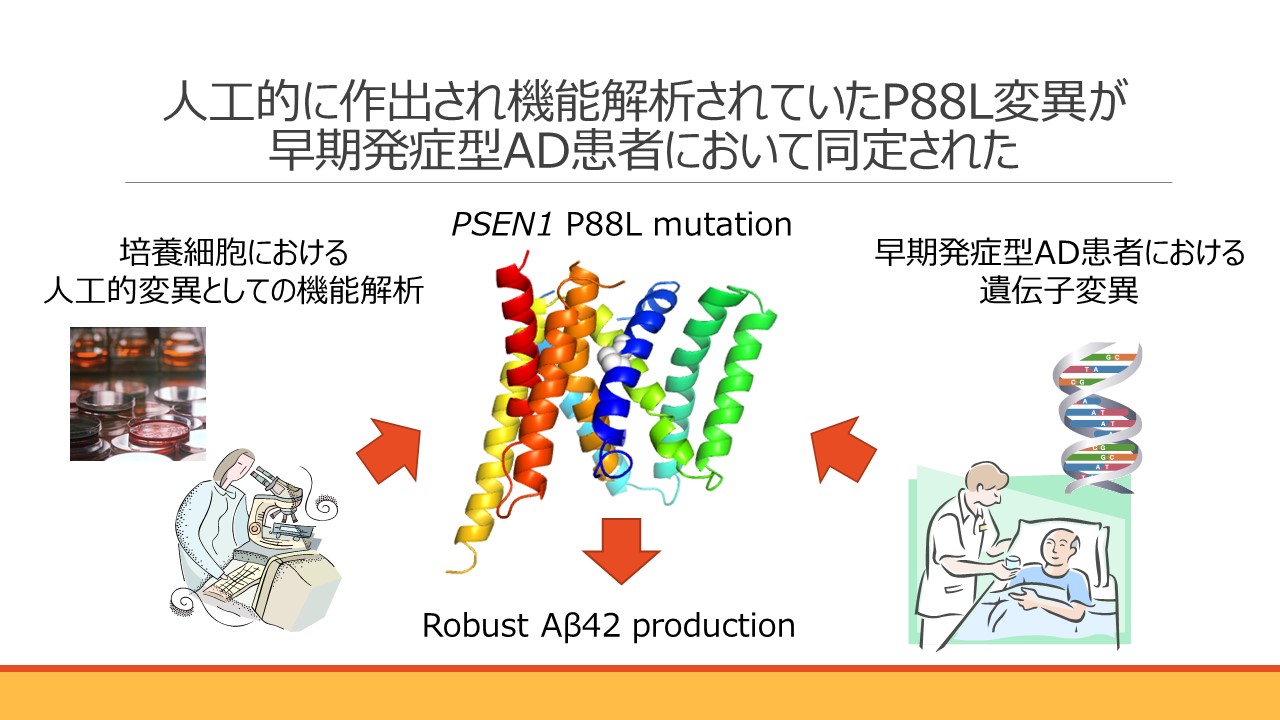
家族性アルツハイマー病原因分子Presenilinの機能構造解析から、第一膜貫通領域が基質認識に関わっていること、そして特に第88番目のプロリンがその機能に重要であることを報告していました 。本論文において様々な遺伝子変異体を人工的に作出し解析する中で、P88L変異が最も強いAβ42産生効果を示すことを見出していましたが、同変異が20代でADを発症された患者様において同定されました。これまで、患者様において見出された遺伝子変異を元に研究を進められてきました。その方向性とは異なり、分子生物学的研究の中から同定された変異が患者様において見出されたことから、本成果はAD発症機構におけるPresenilinの機能解析研究に大きな裏付けを与えるものです。本研究は南カリフォルニア大学 John M. Ringman教授らとの共同研究の成果です。
2016年
2016年7月28日
Partial loss of CALM function reduces Aβ42 production and amyloid deposition in vivo Kunihiko Kanatsu, Yukiko Hori, Sho Takatori, Toshio Watanabe, Takeshi Iwatsubo, Taisuke Tomita Hum. Mol. Genet. (2016) doi: 10.1093/hmg/ddw239 First published online: July 27, 2016
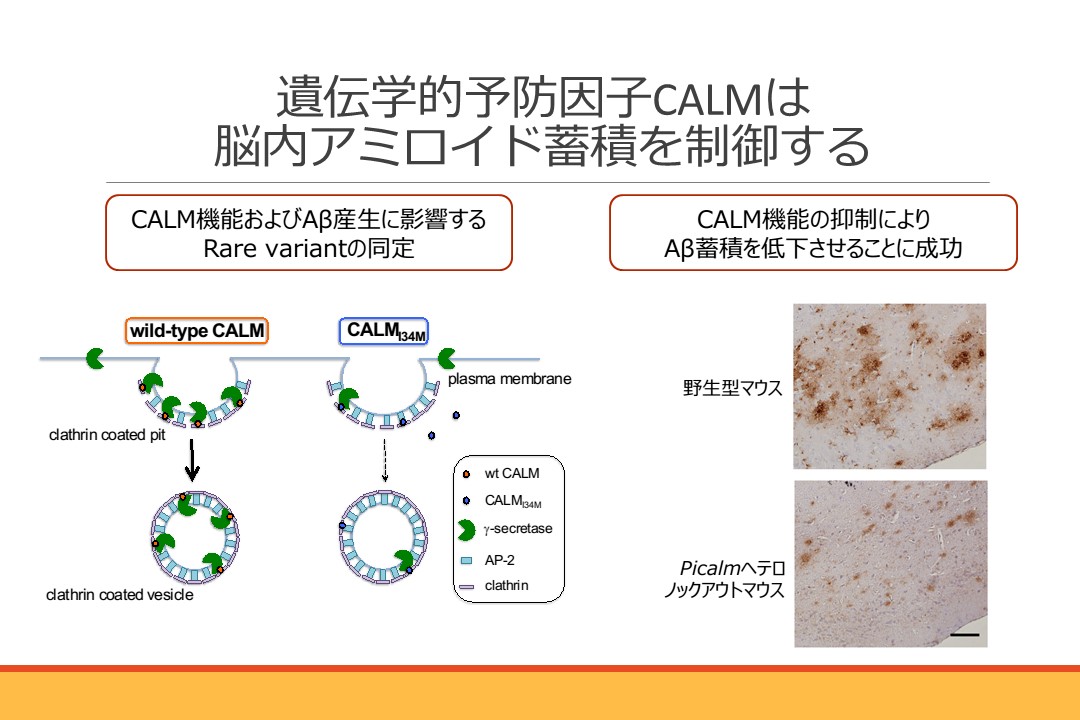
私たちはこれまでに遺伝学的アルツハイマー病発症予防因子PICALMがコードするCALMタンパク質がアミロイドβタンパク質(Aβ)産生を担う酵素γセクレターゼの細胞内輸送および活性を制御することを明らかにしていました。 今回、そのメカニズムについてさらに詳細に検討し、CALMのN末端側に存在するANTHドメインとPI(4,5)P2の結合がγセクレターゼ活性制御に重要であることを見出しました。またRare VariantであるI34M変異がPI(4,5)P2との結合を抑制し、Aβ42産生を低下することを発見し、この変異を持つ人はアルツハイマー病の発症が予防されている可能性を示唆しました。またモデルマウスを用いてCALM機能を半減させることでアミロイド蓄積を顕著に抑制することに成功しました。本成果は、遺伝学的予防因子CALMの部分的な機能抑制がAβ蓄積を抑制し画期的アルツハイマー治療となる可能性について、世界で初めて同定したものです。本研究は奈良女子大学大学院人間文化研究科 渡邊利雄教授、医学系研究科 岩坪威教授との共同研究の成果です。
2016年5月9日
BIN1 regulates BACE1 intracellular trafficking and amyloid-β production Toji Miyagawa, Ihori Ebinuma, Yuichi Morohashi, Yukiko Hori, Mee Young Chang, Haruhiko Hattori, Tomoaki Maehara, Satoshi Yokoshima, Tohru Fukuyama, Shoji Tsuji, Takeshi Iwatsubo, George C. Prendergast, Taisuke Tomita
Hum. Mol. Genet. (2016) doi: 10.1093/hmg/ddw146 First published online: May 14, 2016
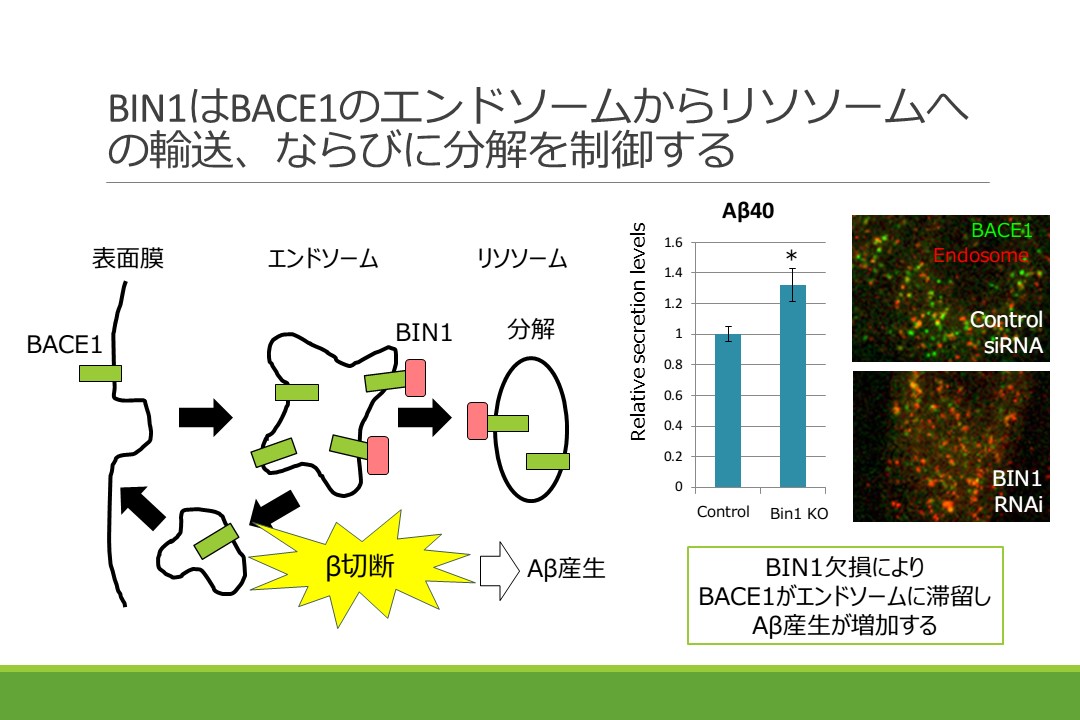
遺伝学的アルツハイマー病発症リスク因子BIN1がアミロイドβタンパク質(Aβ)産生の第一段階目の切断を担う酵素BACE1の細胞内輸送および分解を制御することでAβ産生量を規定していることを明らかにしました。BIN1 遺伝子の個々人の違いはアルツハイマー病発症リスクとしてApoEについて二番目に強い影響をもたらします。その遺伝子産物であるBIN1は細胞内小胞輸送に関わるアダプター分子であることが推測されていましたが、アルツハイマー病発症メカニズムにおける役割は不明でした。ノックアウトマウス由来神経細胞やRNAiなどを用い、BIN1タンパク質が細胞表面膜からエンドサイトーシスされたBACE1のエンドソームからリソソームへの輸送を制御していること、その結果エンドソームで生じるβ切断効率を変化させること、またBACE1と直接結合していることを明らかにしました。本成果は、遺伝学的なリスク因子として重要なBIN1がアルツハイマー発症機構においてAβ産生に及ぼす影響について、世界で初めて同定したものです。本研究は名古屋大学大学院創薬科学研究科 横島聡准教授、福山透教授、医学系研究科 辻省次教授、岩坪威教授、Lankenau Institute for Medical Research George C. Prendergast教授との共同研究の成果です。紹介記事がUTokyo Research(2016.9.29) へ掲載されました。
2016年4月4日
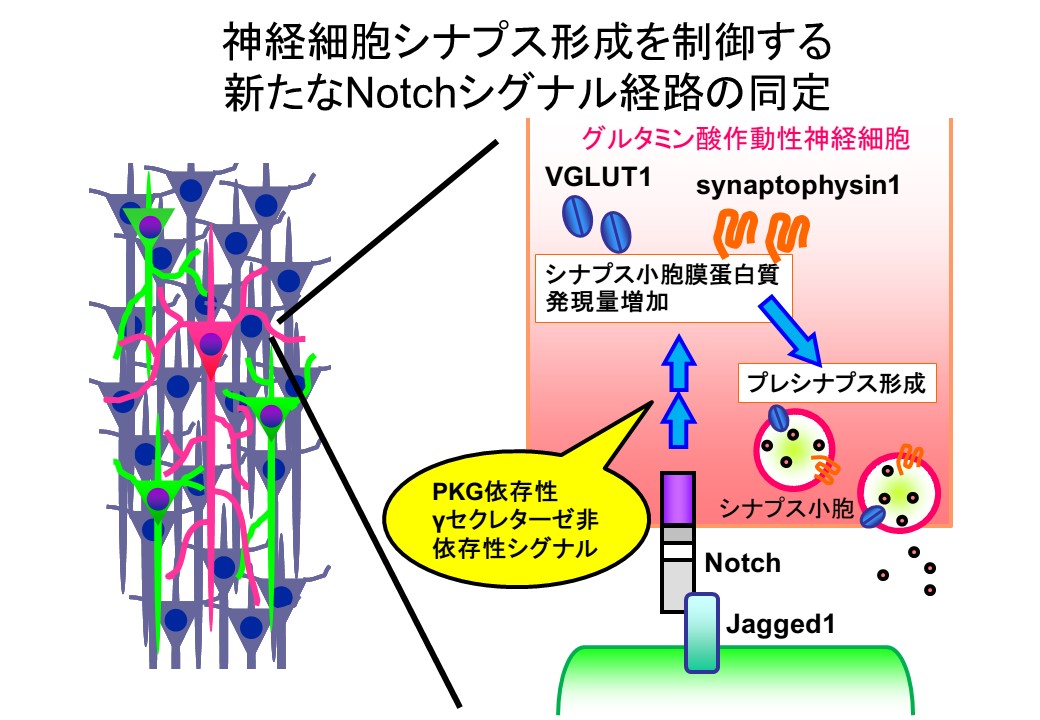
A novel non-canonical Notch signaling regulates expression of synaptic vesicle proteins in excitatory neurons Yukari Hayashi, Hiroshi Nishimune, Katsuto Hozumi, Yumiko Saga, Akihiro Harada, Michisuke Yuzaki, Takeshi Iwatsubo, Raphael Kopan and Taisuke Tomita
Scientific Reports 6, Article number: 23969 (2016) doi:10.1038/srep23969
Notchはリガンドによる活性化を受けた後、γセクレターゼによって切断を受けて産生される細胞質内領域が転写活性化因子として作用するタンパク分解依存性シグナル伝達機構で、発生・分化制御や幹細胞の維持などに関わっています。一方、成体の中枢神経系においてはNotchが神経可塑性や機能に関わっていることが示されていましたが、そのメカニズムは不明でした。我々は生化学および遺伝学を駆使し、Notchリガンドが神経細胞におけるシナプス小胞タンパクの発現量を上昇させプレシナプス形成を誘導していること、またその効果が興奮性シナプスにおいてのみ観察されることを見出しました。さらに興味深いことに、この現象はγセクレターゼ阻害薬では影響を受けず、cGMP依存性キナーゼPKG阻害薬によって抑制されました。これはNotchが分化の終了した神経細胞においてはγセクレターゼ非依存性の新しいシグナル経路を介してシナプス機能を制御していることを明らかにしたものです。本研究はUniversity of Kansas 西宗裕史准教授、東海大学医学部 穂積勝人准教授、遺伝学研究所 相賀裕美子教授、大阪大学医学部 原田彰宏教授、慶応大学医学部 柚崎通介教授、医学系研究科 岩坪威教授、University of Cincinnati Raphael Kopan教授との共同研究の成果です。
2016年1月27日
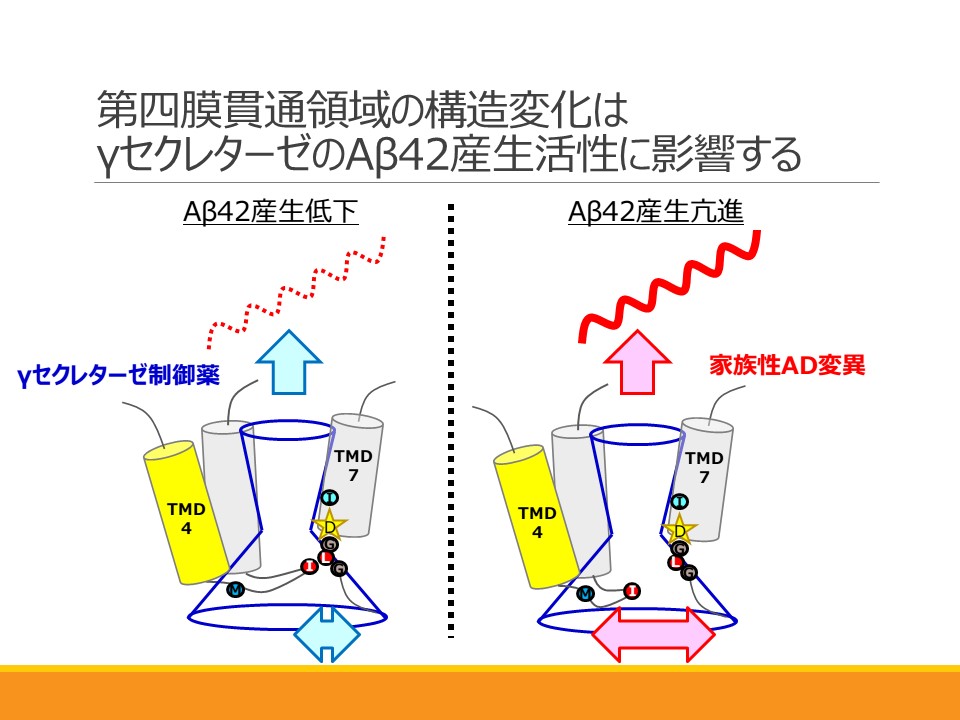
Conformational Changes in Transmembrane Domain 4 of Presenilin 1 Are Associated with Altered Amyloid-β 42 Production Aya Tominaga, Tetsuo Cai, Shizuka Takagi-Niidome, Takeshi Iwatsubo, and Taisuke Tomita
The Journal of Neuroscience, 27 January 2016, 36(4): 1362-1372; doi: 10.1523/JNEUROSCI.5090-14.2016
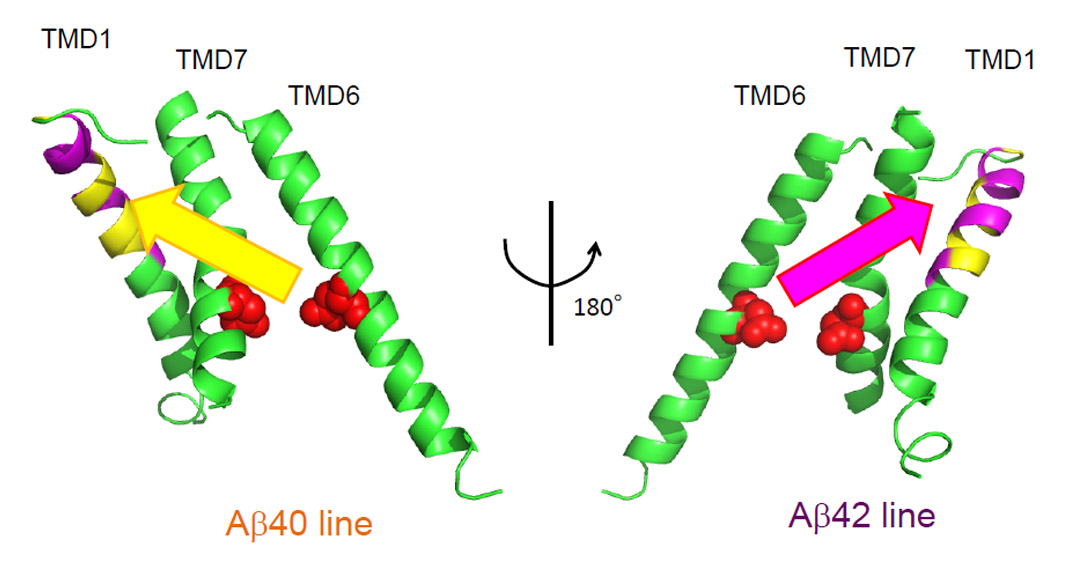
Aβ産生酵素であるγセクレターゼの全体構造については、近年単粒子構造解析によって明らかとなってきました。その中でγセクレターゼが複数のコンフォメーションを取りうることが示され、基質を捕捉し切断を行う過程でダイナミックな構造変化を生じることが推測されています。しかしその詳細は未だ明らかではありません。今回私達は、γセクレターゼの活性中心のサブユニットであるプレセニリンの第四膜貫通領域が特にアルツハイマー病の原因物質であり、毒性の高いAβ42を多く産生する際に大きく構造を変化させていることをを示しました。本成果は、γセクレターゼが毒性分子を産生する特異的な構造変化を世界で初めて同定したものです。この成果に基づき、Aβ42産生のみを抑制する、副作用のないアルツハイマー病の治療薬開発につながることが期待されます。
2015年
2015年2月11日
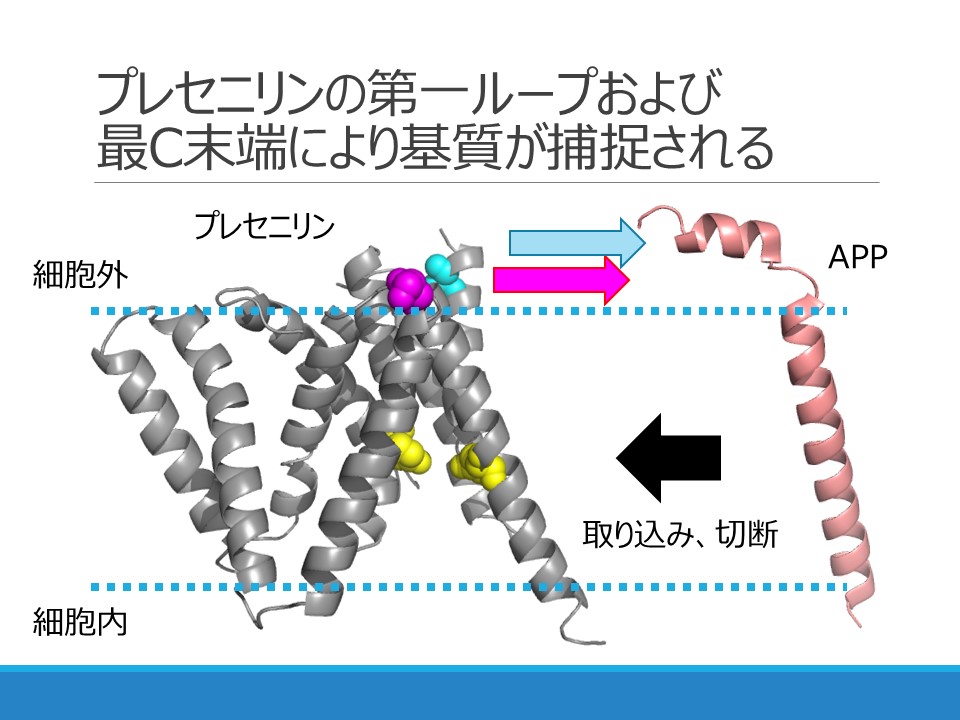
Cooperative Roles of Hydrophilic Loop 1 and the C-Terminus of Presenilin 1 in the Substrate-Gating Mechanism of γ-Secretase Shizuka Takagi-Niidome, Tomoki Sasaki, Satoko Osawa, Takeshi Sato, Kanan Morishima, Tetsuo Cai, Takeshi Iwatsubo, and Taisuke Tomita
The Journal of Neuroscience, 11 February 2015, 35(6): 2646-2656; doi: 10.1523/JNEUROSCI.3164-14.2015
Aβを産生する酵素であるγセクレターゼは他のタンパク質も切断するはたらきがあるため、単純にγセクレターゼを阻害するだけでは副作用が引き起こされることが示されていました。またγセクレターゼがどのようにして基質を認識しているかは不明でした。今回私達は、γセクレターゼの活性中心のサブユニットであるプレセニリンの細胞外に面している第一ループ領域とカルボキシ末端が、箸のように協調的に基質の細胞外領域を補まえて、活性中心の構造に取り込んでいることを示しました。本成果は、γセクレターゼが基質の膜内配列を切断する上で基質を補まえる分子領域を世界で初めて同定したものです。この成果に基づき、Aβ産生のみを抑制する、副作用のないアルツハイマー病の治療薬開発につながることが期待されます。本研究は医学系研究科岩坪威教授、大阪大学大学院 佐藤毅講師との共同研究の成果です。紹介記事がUTokyo Research (2015.2.20)へ掲載されました。
2014年
2014年7月10日
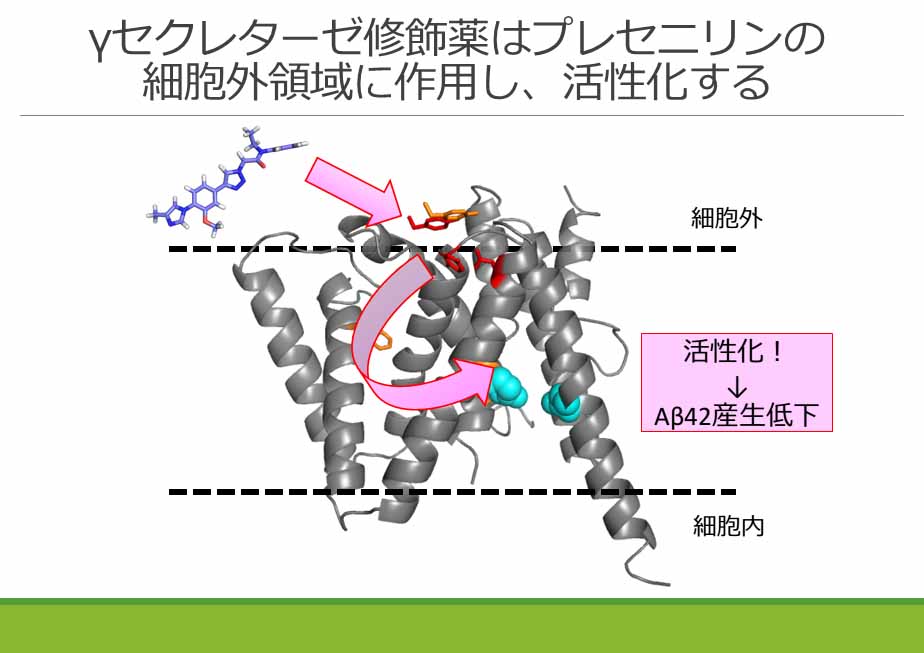
Allosteric regulation of γ-secretase activity by a phenylimidazole-type γ-secretase modulator Koji Takeo, Shun Tanimura, Takehiro Shinoda, Satoko Osawa, Ivan Krasmirov Zahariev, Naoki Takegami, Yoshiko Ishizuka-Katsura, Naoko Shinya, Shizuka Takagi-Niidome, Aya Tominaga, Noboru Ohsawa, Tomomi Kimura-Someya, Mikako Shirouzu, Satoshi Yokoshima, Shigeyuki Yokoyama, Tohru Fukuyama, Taisuke Tomita, and Takeshi Iwatsubo Proceedings of the National Academy of Sciences, Published online before print July 9, 2014, doi: 10.1073/pnas.1402171111
低分子化合物が、どのようなメカニズムで薬理作用を発揮しているのか、またどの部位に結合しているかについての情報は、創薬におけるラショナルデザインに必須です。今回、私達はアルツハイマー症治療薬として開発されているフェニルイミダゾール型γセクレターゼ修飾薬が、γセクレターゼ活性を阻害するのではなく亢進させることでAβをさらに切断・分解し、結果的にAβ産生を低下させていることを明らかにしました。またその作用部位が、プレセニリンの細胞外領域によって構成されていることを見出しました。この相互作用様式の詳細をさらに明らかにすることにより、新たなアルツハイマー症治療薬のラショナルデザインにつながると期待されます。本研究は薬学系研究科横島聡元准教授、福山透元教授(現、名古屋大学大学院創薬科学研究科)、医学系研究科岩坪威教授、理化学研究所 横山茂之上席研究員、白水美香子部門長、篠田雄大研究員との共同研究の成果です。紹介記事がAlzforum (2014.7.11)、UTokyo Research
(2014.7.23)、毎日新聞朝刊 (2014.7.31)、医療介護CB news (2014.8.1)へ掲載されました。
2014年3月1日
Decreased CALM expression reduces Aβ42 to total Aβ ratio through clathrin-mediated endocytosis of γ-secretase Kunihiko Kanatsu, Yuichi Morohashi, Mai Suzuki, Hiromasa Kuroda, Toshio Watanabe, Taisuke Tomita and Takeshi Iwatsubo Nature Communications 5, Article number: 3386, doi:10.1038/ncomms4386
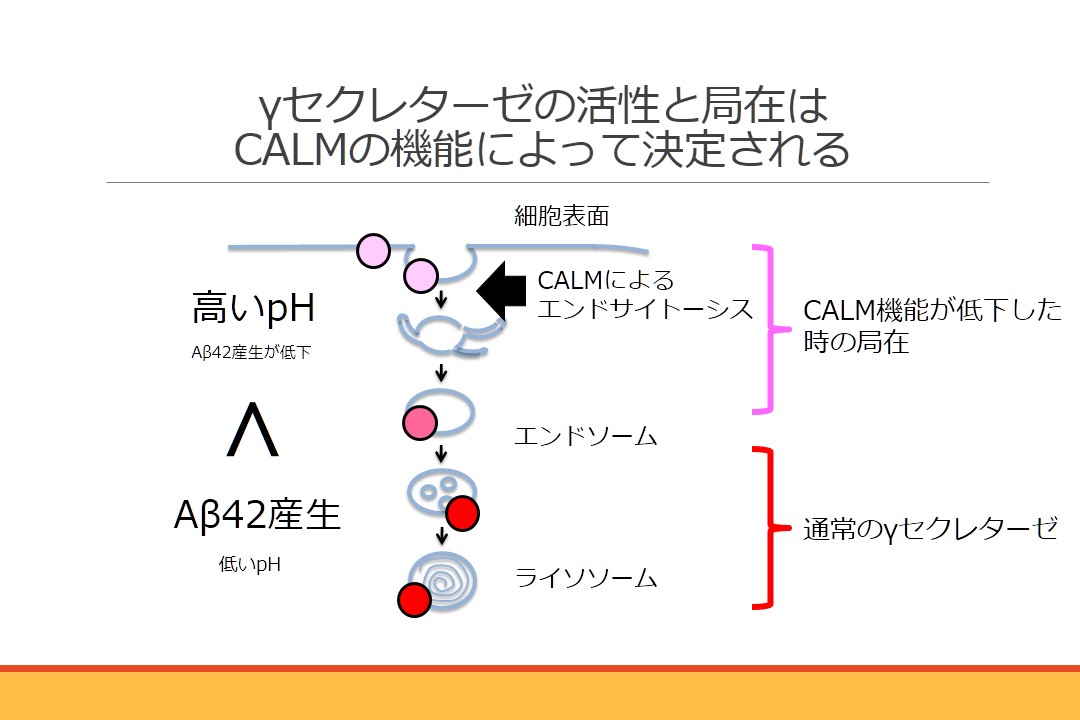
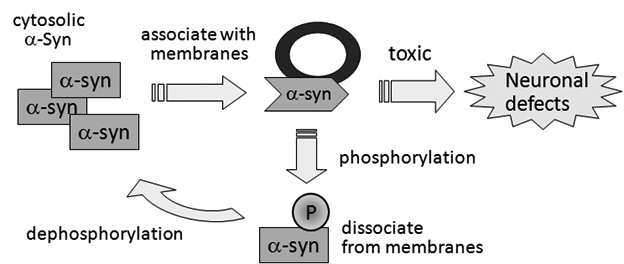
アルツハイマー病の発症予防因子CALM(カルム)タンパク質が、アミロイドβタンパク質産生酵素γセクレターゼの細胞内局在を制御していることを明らかにしました。この酵素の活性はpHによる影響を大きく受け、特に酸性環境下で凝集性の高いAβ42を多く産生することを見出しました。CALMをコードしているPICALM遺伝子近傍に存在する一塩基多型がアルツハイマー病発症リスクを13%低下させることが知られており、本研究成果から予防アレルを持つ人ではAβ42産生が抑制されて可能性が示唆されました。今後、CALMの機能のみを抑制する方法を明らかにすることにより、アルツハイマー病の予防法の開発につながる他、PICALM遺伝子多型によるリスク評価とテーラーメード医療につながることが期待されます。 本研究は奈良女子大学大学院人間文化研究科 渡邊利雄教授との共同研究の成果です。
東京大学のプレスリリース 、本論文に関する日経バイオテク(14.3.1) 、朝日新聞デジタル(14.3.1) 、マイナビニュース(14.3.4) 、医療介護CBニュース(14.3.6) 、毎日新聞ウェブサイト(14.3.13) の報道については、それぞれリンク先をご覧ください。本研究成果については14.3.3付朝日新聞夕刊、14.3.13付毎日新聞朝刊に掲載されました。
2014年1月11日
Binding of longer Aβ to transmembrane domain 1 of presenilin 1 impacts on Aβ42 generation Yu Ohki, Naoaki Shimada, Aya Tominaga, Satoko Osawa, Takuya Higo, Satoshi Yokoshima, Tohru Fukuyama, Taisuke Tomita and Takeshi Iwatsubo Molecular Neurodegeneration 2014 Jan 13;9(1):7
γセクレターゼの活性中心サブユニットプレセニリンがどのようにしてAβのC末端長を決定しているかについては明らかになっていません。私達は2011年にAβ42産生を変化させるGSM-1がプレセニリンの第一膜貫通領域に結合することを報告しました(Ohki et al., EMBO J 2011)。今回、異なる構造を持ちAβ42産生を上昇させる低分子化合物Fenofibrateも第一膜貫通領域に結合することを見出しました。そしてこの領域と、APP切断中間産物である「長いAβ」の選択的な結合が、Aβ42産生量に影響を与えることを明らかにしました。本研究はγセクレターゼによる膜内配列切断機構の解明につながると同時に、プレセニリンの第一膜貫通領域がアルツハイマー病治療薬候補であるGSMの創薬標的領域となりうることを示しています。本研究は本学大学院薬学系研究科天然物合成化学教室(現、名古屋大学大学院創薬科学研究科)との共同研究の成果です。
2013年
2013年6月11日
Protein trafficking and maturation regulate intramembrane proteolysis Yuichi Morohashi and Taisuke Tomita Biochim Biophys Acta. 2013 Dec;1828(12):2855-61. doi: 10.1016/j.bbamem.2013.06.001. Epub 2013 Jun 11. Review.
現在までに膜内配列切断酵素としてSite 2 Protease、Rhomboidそしてγセクレターゼファミリー分子が知られています。いずれも複数回膜貫通型タンパクが酵素であり、一回膜貫通型タンパクを基質とします。そのため、細胞内小胞輸送によってこれらの切断や活性が制御されていることが知られています。膜内配列切断に関する特集号の中で、切断現象を制御する細胞内小胞輸送の機能的連関について、reviewを執筆させて頂きました。
2013年5月7日
FTY720/Fingolimod, a Sphingosine Analogue, Reduces Amyloid-β Production in Neurons Nobumasa Takasugi,Tomoki Sasaki,Ihori Ebinuma,Satoko Osawa,Hayato Isshiki,Koji Takeo,Taisuke Tomita,Takeshi Iwatsubo PLoS ONE 8(5): e64050. doi:10.1371/journal.pone.0064050
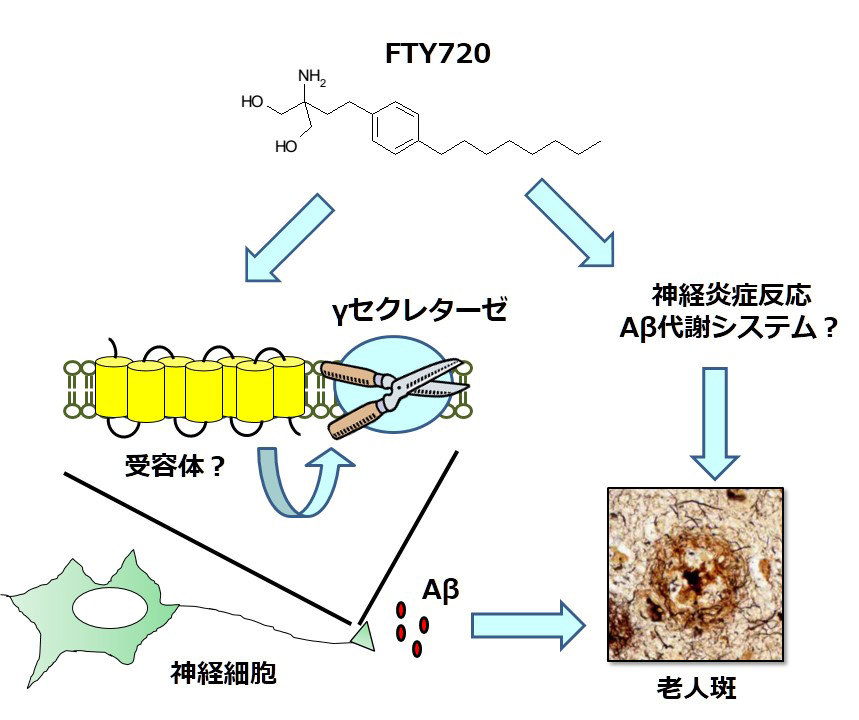
スフィンゴシン1リン酸受容体に対する機能性アンタゴニストであるFY720はフィンゴリモドとして多発性硬化症治療薬として使用されている免疫抑制剤です。私たちはこのFTY720が培養神経細胞においてγセクレターゼ活性を抑制し、Aβ産生を抑制することを見出しました。またその分子機構として、既知のスフィンゴシン1リン酸受容体を介したシグナル伝達機構とは異なることも明らかとなりました。一方、ADモデルマウスに6日間投与した場合、脳内Aβ40量が低下するにもかかわらず、脳内Aβ42量は増加するということが明らかになりました。免疫抑制剤としてのFTY720の薬効を考慮すると、これらの結果はFTY720がAβ産生機構のみならず、神経炎症システムを変化させることで脳内Aβ量を制御しうる可能性を示唆しています。今後さらに詳細な解析を行うことで、新しい脳内Aβレベルの制御方法の開発につながることが期待されます。
2013年8月8日
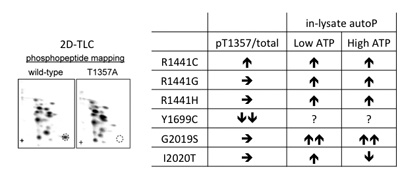
Differential effects of familial Parkinson mutations in LRRK2 revealed by a systematic analysis of autophosphorylation Shogo Kamikawaji*, Genta Ito*, Tomoko Sano and Takeshi Iwatsubo (*equal contribution)Biochemistry in press. First published on August 8, 2013, doi: 10.1021/bi400596m
Leucine-rich repeat kinase 2(LRRK2)は家族性パーキンソン病(FPD; PARK8)の病因遺伝子産物です。現在までに、R1441C/G/H、Y1699C、G2019S、I2020Tの6種類のアミノ酸置換がPARK8の原因となることが知られていますが、そのメカニズムはよくわかっていません。今回私たちは、2次元薄層クロマトグラフィーによるホスホペプチドマッピングを行い、LRRK2の主要な自己リン酸化部位としてThr1348、Thr1349、Thr1357を同定しました。また、Y1699C変異によりThr1357における自己リン酸化が選択的に抑制されること、低濃度のATP存在下において、解析対象外のY1699C変異体を除くすべての変異体が野生型に比して高い自己リン酸化能を発揮することを発見しました。これらの結果から、細胞内ATP濃度が異常に低下した条件下では、FPD変異型LRRK2は野生型LRRK2より高いキナーゼ活性を発揮する可能性が示唆されました。そのような条件下で過剰リン酸化される基質タンパク質の探索から、FPD変異型LRRK2が神経変性を引き起こす分子メカニズムの解明につながる重要な知見です。
2013年6月25日
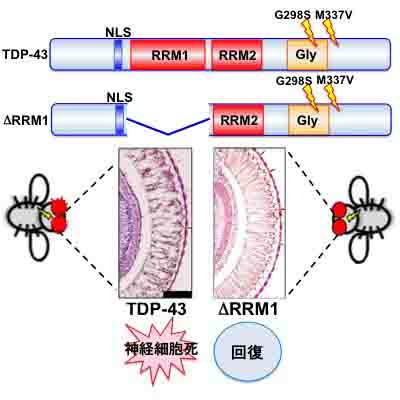
RNA binding mediates neurotoxicity in the transgenic Drosophila model of TDP-43 proteinopathy Ryoko Ihara, Koji Matsukawa, Yusei Nagata, Hayato Kunugi, Shoji Tsuji, Takahiro Chihara, Erina Kuranaga, Masayuki Miura, Tomoko Wakabayashi, Tadafumi Hashimoto and Takeshi Iwatsubo Human Molecular Genetics in press
TDP-43は家族性筋萎縮性側索硬化症(ALS)の病因遺伝子であり、家族性及び孤発性ALS患者の運動ニューロンや、前頭側頭葉型変性症(FTLD)患者の大脳皮質において、細胞内封入体として蓄積することが知られています。しかし、これまでどのようにしてTDP-43が神経変性を引き起こすか不明でした。私たちはショウジョウバエの複眼や運動ニューロンにTDP-43を過剰発現させることにより、進行性の神経細胞死を引き起こすモデル動物を作出し、家族性ALSに連鎖するTDP-43の変異や、TDP-43を細胞質に局在させる変異は神経細胞変性を増悪させることを見出しました。さらに、TDP-43はDNA/RNA結合タンパク質であることから、TDP-43のRNA結合能と神経細胞死との関わりを検討したところ、RNA結合能を失ったTDP-43は神経細胞死を引き起こさないことを発見しました。これらの結果は、TDP-43がRNA結合を介して神経細胞死を引き起こすことを示すものであり、神経難病であるALSやFTLDの病因解明、根本治療薬開発に重要な手がかりを与えると期待されます。本研究は本学大学院医学系研究科神経内科学教室、薬学系研究科遺伝学教室との共同研究の成果です。
新しい論文がBiochimica et Biophysica Acta (BBA) - Biomembranesに発表されました
Protein trafficking and maturation regulate intramembrane proteolysis Yuichi Morohashi, Taisuke Tomita BBA Biomembranes in press
膜内配列切断に関する特集号の中で、切断現象を制御する細胞内小胞輸送の機能的連関について、reviewを執筆させて頂きました。
新しい論文がPLoS ONEに発表されました
FTY720/Fingolimod, a Sphingosine Analogue, Reduces Amyloid-β Production in Neurons Nobumasa Takasugi,Tomoki Sasaki,Ihori Ebinuma,Satoko Osawa,Hayato Isshiki,Koji Takeo,Taisuke Tomita,Takeshi Iwatsubo PLoS ONE 8(5): e64050. doi:10.1371/journal.pone.0064050
スフィンゴシン1リン酸受容体に対する機能性アンタゴニストであるFY720はフィンゴリモドとして多発性硬化症治療薬として使用されている免疫抑制剤です。私たちはこのFTY720が培養神経細胞においてγセクレターゼ活性を抑制し、Aβ産生を抑制することを見出しました。またその分子機構として、既知のスフィンゴシン1リン酸受容体を介したシグナル伝達機構とは異なることも明らかとなりました。一方、ADモデルマウスに6日間投与した場合、脳内Aβ40量が低下するにもかかわらず、脳内Aβ42量は増加するということが明らかになりました。免疫抑制剤としてのFTY720の薬効を考慮すると、これらの結果はFTY720がAβ産生機構のみならず、神経炎症システムを変化させることで脳内Aβ量を制御しうる可能性を示唆しています。今後さらに詳細な解析を行うことで、新しい脳内Aβレベルの制御方法の開発につながることが期待されます。
新しい論文がJournal of Biological Chemistryに発表されました
Structural biology of presenilins and signal peptide peptidases Taisuke Tomita, Takeshi Iwatsubo J Biol Chem 288(21):14673-14680, 2013. doi: 10.1074/jbc.R113.463281
これまでの我々のγセクレターゼに関連する構造活性相関解析の概説を、最近発表されたGxGDプロテアーゼのx線結晶構造解析の解説と合わせてJBCのMinireviewに執筆させて頂きました。
岩坪威教授が第10回高峰記念第一三共賞を受賞しました
"アルツハイマー病におけるβアミロイド形成機構・抑制薬に関する研究並びに画像・バイオマーカーを用いた治療薬の開発研究"により、岩坪威教授が第10回高峰記念第一三共賞を受賞しました。
2012年
新しい論文がJournal of Medicinal Chemistryに発表されました
Effect of Helical Conformation and Side-Chain Structure on γ-Secretase Inhibition by β-Peptide Foldamers: Insight into Substrate Recognition. Yuki Imamura, Naoki Umezawa, Satoko Osawa, Naoaki Shimada, Takuya Higo, Satoshi Yokoshima, Tohru Fukuyama, Takeshi Iwatsubo, Nobuki Kato, Taisuke Tomita, and Tsunehiko Higuchi J Med Chem. 2013 Jan 23. [Epub ahead of print]
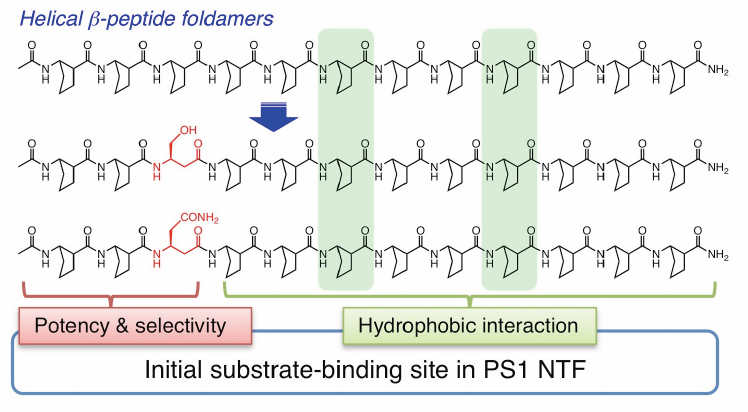
セクレターゼの単純な阻害は発生・分化にかかわるNotchシグナルの抑制などによる副作用が予見されており、基質認識機構に基づいたラショナルな活性制御化合物の開発が求められています。我々は以前、 アミノ酸と呼ばれる非天然アミノ酸を用いヘリックス構造を固定した ペプチドフォルダマーが強力なγセクレターゼ阻害剤となることを見出しました(Imamura et al., JACS 2009)。今回、フォルダマーを構成するアミノ酸側鎖を体系的に検討し、阻害濃度と基質選択性に関わるアミノ酸のポジションを決定すると同時に、光親和性標識法などのケミカルバイオロジー的手法を駆使して、既知のスルホンアミド型γセクレターゼ阻害剤とは異なるメカニズムによって基質選択性が生み出されていることを明らかにしました。疎水性である膜内配列を加水分解する新奇活性を示すγセクレターゼの切断メカニズムを考える上でも、重要な知見です。 今後このフォルダマーのデザインを改変していくことで、Aβペプチドの産生のみを特異的に抑制することが可能な、基質特異的γセクレターゼ阻害剤の開発につながることが期待されます。本研究は、名古屋市立大学精密有機反応学分野(樋口恒彦教授、梅澤直樹准教授)、名古屋大学大学院創薬科学研究科天然物化学分野(福山透教授、横島聡准教授)との共同研究成果です。
第17回武田科学振興財団生命科学シンポジウムにおいて、M2の山本薫さんがポスター賞を受賞しました!
新しい論文がBiochemistryに発表されました
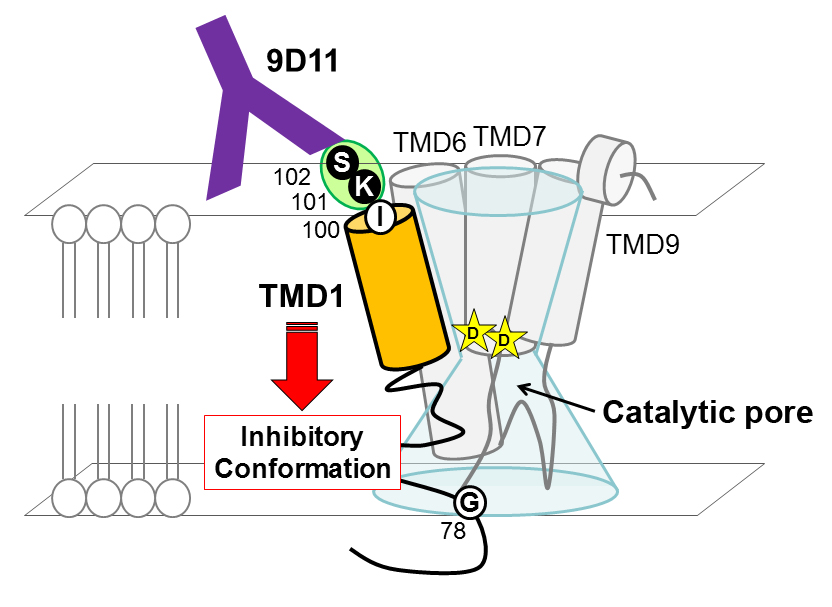
Inhibition of γ-secretase activity by a monoclonal antibody against the extracellular hydrophilic loop of presenilin 1 Takagi-Niidome S, Osawa S, Tomita T, Iwatsubo T. Biochemistry. 2013 Jan 8;52(1):61-9. doi: 10.1021/bi301252r.
プレセニリン(PS)はアルツハイマー病発症にかかわるアミロイドβタンパク質の産生や、幹細胞の維持にかかわるNotchを切断する酵素γセクレターゼの活性中心サブユニットです。私たちはこれまでにシステイン残基の特異的化学反応性を利用してPSの構造活性相関を明らかにしてきました。今回、構造生物学的情報に基づいたγセクレターゼ活性制御法のラショナルデザインを目指し、PS1のループ領域に対する特異的抗体9D11を作出しました。そして9D11がγセクレターゼ活性に対する機能阻害抗体として働き、アミロイドβ蛋白の産生を抑制する他、γセクレターゼ活性依存性に増殖を示すがん細胞の生存を抑制することを見出しました。9D11は世界で初めて開発に成功したPSに対する阻害抗体であり、特に第一膜貫通領域のダイナミックなモーションがγセクレターゼの基質切断機構に重要という我々の以前の知見を確認できたものです(Takagi et al., J Neurosci 2010)。これらの情報は、構造情報に基づいたγセクレターゼを標的とする治療薬の開発において重要な知見であると考えられます。
新しい論文がNeuronに発表されました
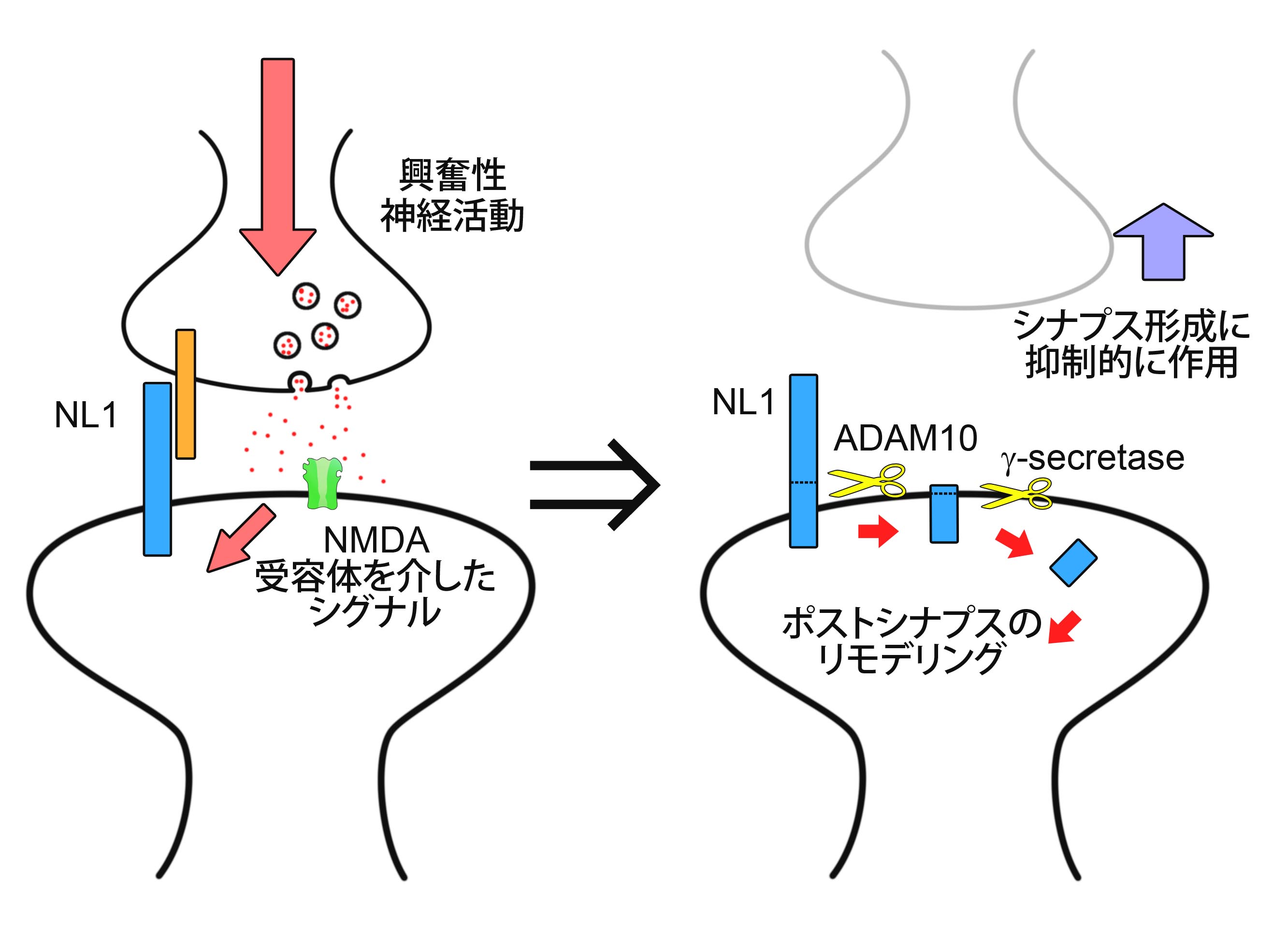
Activity-Dependent Proteolytic Cleavage of Neuroligin-1 Suzuki K, Hayashi Y, Nakahara S, Kumazaki H, Prox J, Horiuchi K, Zeng M, Tanimura S, Nishiyama Y, Osawa S, Sehara-Fujisawa A, Saftig P, Yokoshima S, Fukuyama T, Matsuki N, Koyama R, Tomita T, Iwatsubo T. Neuron 76:410-422 (2012)
シナプスは神経活動に応じて結合様式や形を変えることが知られています。シナプス形成の異常は自閉症などの精神性疾患の原因となることが知られており、現在、シナプス形成に関わる分子の特定が盛んに行われています。しかし、いまだ不明の点が多く、特に、神経活動からシナプス形成までの一連の流れについてはほとんど調べられていませんでした。我々は、興奮性シナプス形成に必須の分子であり、自閉症の発症と関連が示されているシナプス膜タンパク質Neuroliginに着目しました。そして、まず興奮性の神経活動によって、タンパク質切断酵素であるプロテアーゼが活性化しNeuroliginが切断を受けること、その結果Neuroliginの量が減少して、神経細胞シナプス形成が制御されるという一連の流れを見出しました。また切断現象の責任プロテアーゼとしてADAM10とγセクレターゼの関与を明らかにしました。 本研究成果は、プロテアーゼによる、シナプス膜タンパク質切断がシナプスの形成と機能を制御している可能性を示した点で重要です。シナプス形成に関わる分子自体が、そもそもどのように制御を受けているのかを調べ、神経活動からシナプス形成までの全体像を初めて明らかにした成果です。今後、シナプス形成に関わる分子ではなく、その量を決めるプロテアーゼが、自閉症治療薬開発の重要な創薬標的分子となりうることも示唆されます。
東京大学のプレスリリースはこちら です。ActiveZone にて"3 new papers in Neuron related to neuroligin-1 roles at synapses"とツイートされました。こちら です。こちら です。東京大学新聞 に掲載されました。SPOTLIGHT として取り上げられました。公開 されています。公開 されています。
新しい論文がThe Journal of Biological Chemistryに発表されました。
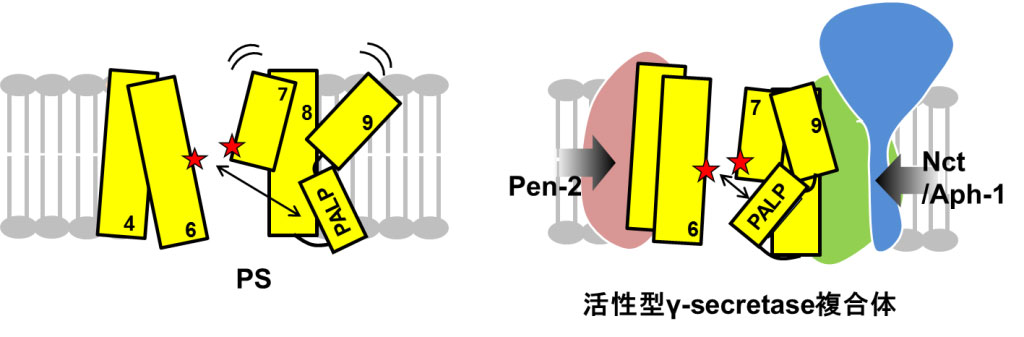
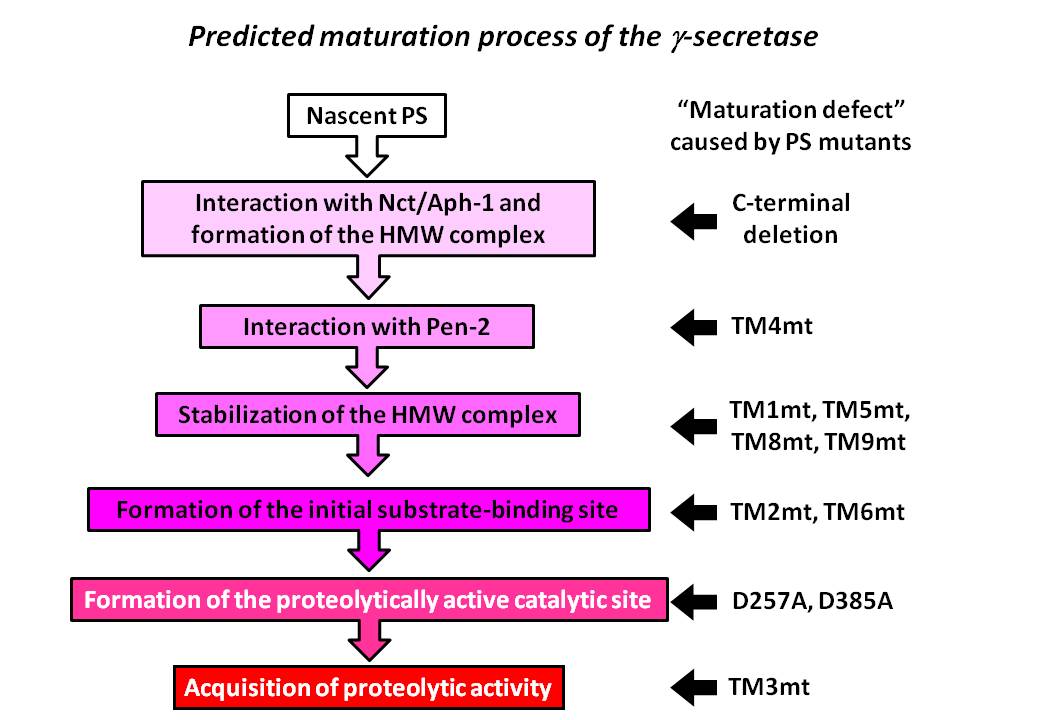
Contribution of the γ-secretase subunits to the formation of catalytic pore of presenilin 1 Koji Takeo, Naoto Watanabe, Taisuke Tomita and Takeshi Iwatsubo The Journal of Biological Chemistry 287(31):25834-25843 (2012) First Published on June 11, 2012
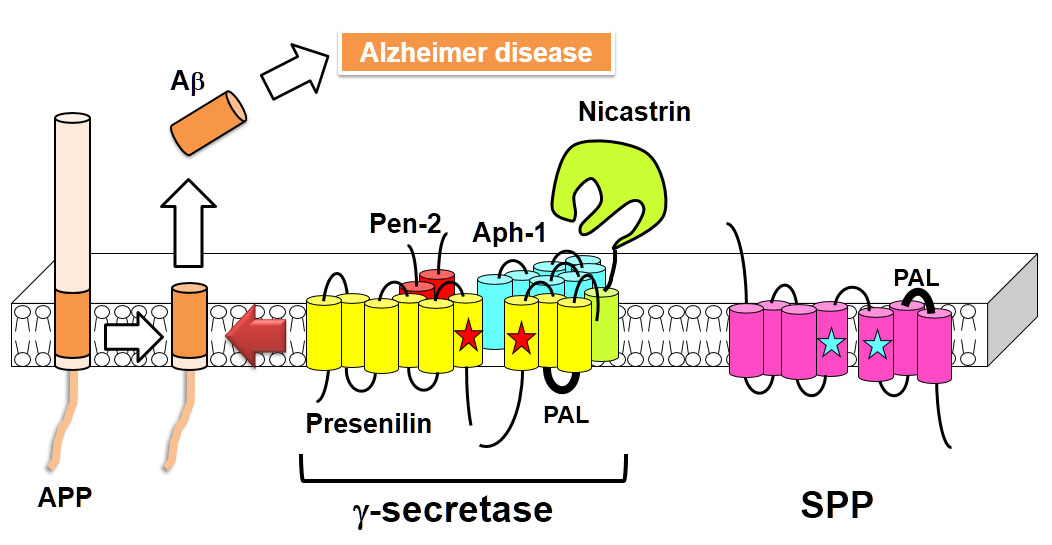
γセクレターゼはアルツハイマー病発症にかかわるアミロイドβタンパク質の前駆体を切断する酵素です。この切断酵素はプレセニリン(PS)、ニカストリン、Aph-1、Pen-2の4つのサブユニットで構成される膜蛋白複合体ですが、活性中心ポア構造がどのように形成されるかについては分かっていませんでした。今回我々はPSの活性中心ポアの構造が他のサブユニットによって制御されている様子を世界で初めて解明しました(スキーム)。サブユニットの結合によって、PSの活性中心ポア構造内のアミノ酸残基に対する水分子のaccessibilityが減少すること、および各アミノ酸残基間の距離が短くなることを発見し、活性中心ポア構造が空間的に限定されることを示しました。これらの情報は、γセクレターゼを標的とする治療薬の開発において重要な知見であると考えられます。
超早期アルツハイマー病の画像診断・バイオマーカー・臨床指標の確立を目指したJ-ADNIへの取り組みにより、岩坪威教授が2012年ポタムキン賞を受賞しました。
本受賞に関する東京大学からのプレスリリースはこちら です。こちら です。
新しい論文がThe Journal of Biological Chemistryに発表されました
Phosphorylation of α-synuclein at Ser129 reduces neuronal dysfunction by lowering its membrane-binding property in Caenorhabditis elegans Tomoki Kuwahara, Reina Tonegawa, Genta Ito, Shohei Mitani and Takeshi Iwatsubo 2012, doi: 10.1074/jbc.M111.237131
近年、無脊椎動物である線虫C.elegansの神経系がパーキンソン病における神経変性のモデルになりうることが示唆されています。私達は代表的な家族性パーキンソン病病因遺伝子であるαシヌクレインおよび各種変異体を神経系に発現させた線虫を用いて、パーキンソン病脳内で特徴的なαシヌクレインのセリン129位リン酸化の役割について解析しました。その結果、αシヌクレインのリン酸化は自身の膜結合性を低下させることにより、神経保護的に働く役割を持つことを見出しました。本知見はαシヌクレインリン酸化をターゲットとした創薬を指向する上で重要な足がかりになるものと期待されます。本研究は東京女子医科大学三谷昌平教授との共同研究成果です。
2010年
新しい論文がThe Journal of Neuroscienceに発表されました
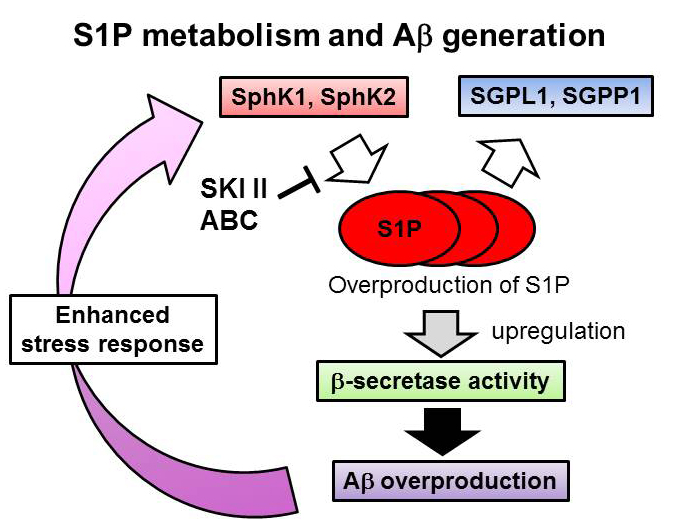
BACE1 Activity Is Modulated by Cell-Associated Sphingosine-1-Phosphate Nobumasa Takasugi, Tomoki Sasaki, Kunimichi Suzuki, Satoko Osawa, Hayato Isshiki, Yukiko Hori, Naoaki Shimada, Takuya Higo, Satoshi Yokoshima, Tohru Fukuyama, Virginia M.-Y. Lee, John Q. Trojanowski, Taisuke Tomita, and Takeshi Iwatsubo The Journal of Neuroscience 31:6850-6857 (2011)
我々は世界で初めてリゾリン脂質の一つであるスフィンゴシン1リン酸(S1P)が神経細胞においてβセクレターゼであるBACE1の活性を制御する因子であることを見出しました。S1Pは様々な生理活性を持つことが知られている脂質で、その産生酵素の一つSphingosine kinase2により合成されるS1PがBACE1活性制御に関与していること、またこのKinase活性がアミロイド線維により亢進することや、アルツハイマー病患者脳において上昇していることを明らかにしました。すなわち、アミロイド毒性がS1P産生を亢進させ、BACE1活性が上昇し、さらなるAβ産生を引き起こす、Vicious cycleが想定されました。すなわち、S1P産生・代謝経路の異常がアルツハイマー病発症過程および増悪化に大きく関与している可能性が考えられ、新たな治療薬標的パスウェイとなることが期待されます。Alzforum に"Lipid Modulator Offers New Route to BACE1 Inhibition"としてfeatureされました。
本研究内容は2010年10月8日付で信濃毎日新聞に掲載されました。
新しい論文がThe Journal of Neuroscienceに発表されました
Participation of transmembrane domain 1 of presenilin 1 in the catalytic pore structure of the γ-secretase Shizuka Takagi, Aya Tominaga, Chihiro Sato, Taisuke Tomita, and Takeshi Iwatsubo The Journal of Neuroscience 30:15943-15950 (2010)
これまで、γセクレターゼの活性中心サブユニットプレセニリンについてはシステインケミストリーを用いた構造解析法SCAMを用いて活性中心ポア構造の存在を示してきました。今回、世界で初めてプレセニリンのアミノ末端側の第一膜貫通領域の構造解析に成功し、活性中心ポア構造に直接面していることを明らかにしました。そして基質の選択性にも関わっていることをあきらかにしました。さらに阻害剤を利用した解析から、この膜貫通領域が切断過程においてピストン様の上下運動をしていることが示唆されました。これは世界で初めてγセクレターゼのダイナミックな構造変化を示唆した研究成果であり、今後の解析から、γセクレターゼによる膜内配列切断機構についてさらに詳細なメカニズムが明らかになることが期待されます。
第29回日本認知症学会において、ポスター発表"γセクレターゼモジュレーターGSM-1はプレセニリンN末端断片を標的とする"により、富田泰輔准教授が学会奨励賞(基礎研究部門)を受賞しました。
学会ホームページはこちら です。
予防薬研究 酵素にも注目」
セクレターゼ活性阻害・制御薬に関する最新の知見について、2010年10月8日付で信濃毎日新聞に掲載されました
新しい論文がThe Journal of Neuroscienceに発表されました
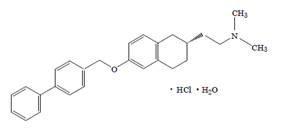
A noncompetitive BACE1 inhibitor TAK-070 ameliorates A pathology and behavioral deficits in a mouse model of Alzheimer's disease Hiroaki Fukumoto, Hideki Takahashi, Naoki Tarui, Junji Matsui, Taisuke Tomita, Mitsuhiro Hirode, Masumi Sagayama, Ryouta Maeda, Makiko Kawamoto, Kazuko Hirai, Jun Terauchi, Yasufumi Sakura, Mitsuru Kakihana, Kaneyoshi Kato, Takeshi Iwatsubo, Masaomi Miyamoto The Journal of Neuroscience vol. 33 pp. 11157-11166 (2010)
BACE1はアミロイドβペプチド(Aβ)産生の律速酵素であり、Aβ抑制療法の標的分子として注目されてきましたが、その阻害薬開発は遅れていました。今回、武田薬品工業創薬研究所の福元宏明主席研究員と我々は、経口投与によりADモデルトランスジェニック(Tg2576)マウス脳でBACE1を抑制する低分子化合物TAK-070の開発に成功しました。TAK-070は(R)-6-[(1,1'-biphenyl)-4-ylmethoxy]- 1,2,3,4-tetrahydro-N,N-dimethyl-2-naphthaleneethanamine hydrochlorideというユニークな構造を持ち、BACE1の膜貫通部分に結合することにより、非競合的にBACE1を抑制するものと考えられます。培養細胞におけるAβ産生抑制能は比較的modestであるものの、Tg2576マウス脳でも同程度にAβ産生を抑制し、その効果は慢性投与実験でも保持されました。またTAK-070の投与はTg2576マウスのY-maze, Morris water maze, novel object recognition などの行動試験における異常を改善しました。TAK-070に代表される、脳移行性の高い経口BACE1低分子阻害薬の、近未来における臨床応用がおおいに期待されます。
本研究内容はAlzforum に"Getting to First BACE: BACE1 Inhibition Takes A Step Forward"としてfeatureされました。
2010年度包括脳ネットワーク 夏のワークショップにおいて、当研究室一色君のポスター"Identification and functional analysis of a substrate-specific genetic modulator for γ-secretase cleavage"が包括脳ネットワーク優秀若手賞(神経科学学会賞、審査分野:病態)を受賞しました!
ICAD2010にて、岩坪教授がHenry Wisniewski Lifetime Achievement Awardを受賞しました
免疫染色を用いた老人斑におけるAβ42の存在の証明から、γセクレターゼの機能構造生物学、パーキンソン病におけるレビー小体の精製とシヌクレインの同定、そして近年ではJ-ADNIの臨床研究に至るmultidisciplinaryな功績が認められました。
新しい論文がBioorganic & Medicinal Chemistry Lettersに発表されました
Novel Notch-sparing γ-secretase inhibitors derived from a peroxisome proliferator-activated receptor agonist library Motonori Kurosumi, Yoshino Nishio, Satoko Osawa, Hisayoshi Kobayashi, Takeshi Iwatsubo, Taisuke Tomita, Hiroyuki Miyachi Bioorganic & Medicinal Chemistry Letters in press
γセクレターゼ阻害剤はアルツハイマー病の根本治療薬として期待されていますが、細胞の分化・維持に関わるNotchシグナルにも必要なプロテアーゼであるため、その単純な阻害は重篤な副作用を惹起します。我々は新規γセクレターゼ阻害剤の探索を行うべく、PPARγアゴニスト誘導体ライブラリーを探索し、Notchシグナルを保持したままAβ産生を抑制する新規Notch-sparing GSIの同定と開発に成功しました。本化合物は新規治療薬開発のシードとなる他、基質特異的な阻害剤開発にを目指したケミカルバイオロジー研究において重要なプローブとなることが期待されます。本研究は岡山大学宮地弘幸教授との共同研究成果です。
新しい論文がThe Journal of Biological Chemistryに発表されました
Functional analysis of the transmembrane domains of presenilin 1: Participation of transmembrane domains 2 and 6 in the formation of initial substrate-binding site of γ-secretase Naoto Watanabe, Shizuka Takagi, Aya Tominaga, Taisuke Tomita, Takeshi Iwatsubo The Journal of Biological Chemistry 2010 285: 19738-19746. First Published on April 23, 2010, doi:10.1074/jbc.M110.101287
γセクレターゼはプレセニリン、ニカストリン、Aph-1、Pen-2を最小構成因子とする膜蛋白複合体です。活性中心サブユニットであるプレセニリンには活性中心ポア構造の他、基質を脂質二重膜内で側方より捕捉する基質結合部位(Initial substrate-binding site)の存在が示唆されています。本研究においてはシステマチックにプレセニリン1(PS1)の膜貫通領域(TMD)を置換してその変異体の機能解析を行う、以前の研究(Watanabe et al., JBC 2005)をさらに進めました。そして各TMDが活性型γセクレターゼ形成過程において果たす役割について明らかにしました(スキーム)。また化合物を利用したケミカルバイオロジーや、システインを用いたクロスリンク実験などを活用し、TMD2とTMD6がPS1の基質結合部位形成に重要であることを明らかにしました。PSの基質結合部位の詳細を明らかにすることによって、基質特異的なγセクレターゼ活性制御、すなわち、副作用の少ないアルツハイマー病治療薬創成につながる可能性があります。
2009年
新しい論文がBioorganic & Medicinal Chemistry Lettersに発表されました。
Development of Photoaffinity Probes for gamma-Secretase Equipped with a Nitrobenzenesulfonamide-type Cleavable Linker Satoshi Yokoshima, Yuzo Abe, Naoto Watanabe, Yoichi Kita, Toshiyuki Kan, Takeshi Iwatsubo, Taisuke Tomita, Tohru Fukuyama Bioorganic & Medicinal Chemistry Letters 2009 Dec 15;19(24):6869-6871. Epub 2009 Oct 23.
γセクレターゼはプレセニリン、ニカストリン、Aph-1、Pen-2を最小構成因子とする膜蛋白複合体ですが、非常に大きな複合体を形成していることなどから、その構成因子には多様性があることが示唆されています。したがってそれぞれ特有のγセクレターゼ複合体を効率よく、穏和な条件で精製することが求められています。また我々は光親和性標識実験による各γセクレターゼ阻害剤と標的分子を架橋して解析を行ってきましたが、その結合部位のために阻害剤と蛋白の高効率精製法の確立が必要でした。今回、私たちは還元条件下で効率よく切断されるニトロベンゼンスルホンアミド官能基を含む新規リンカーの開発に成功しました。今後このリンカーをさらに改変していくことで、各種阻害剤に結合するgセクレターゼ複合体の新規構成因子の同定につながることが期待されます。本研究は、本学天然物合成化学教室(福山透教授、横島聡講師)との共同研究成果です。
新しい論文がCancer Scienceに発表されました
Dual antitumor mechanisms of Notch signaling inhibitor in a T-cell acute lymphoblastic leukemia xenograft model. Shigeo Masuda, Keiki Kumano, Takahiro Suzuki, Taisuke Tomita, Takeshi Iwatsubo, Hideaki Natsugari, Arinobu Tojo, Makoto Shibutani, Kunitoshi Mitsumori, Yutaka Hanazono, Seishi Cancer Science 2009; 100: 2444-2450
γセクレターゼはアルツハイマー病にかかわるアミロイドβ産生のみならず、細胞の分化・維持に深くかかわるNotchシグナリングに必要な酵素です。近年、Notchシグナルの異常がさまざまながんの発症にかかわることが示されつつあり、γセクレターゼ活性制御によるがん治療法開発が注目を浴びています。今回私たちはγセクレターゼ阻害剤がT細胞性急性リンパ性白血病モデルに有効であることを示し、その分子機構について、がん細胞をアポトーシスに導くcell autonomousな効果と、血管新生に対するnon cell autonomousな効果があることを明らかにしました。本研究は筑波大学千葉滋教授、帝京大学夏苅英昭教授との共同研究成果です。
新しい論文がBiochemistryに発表されました
Identification of autophosphorylation sites of LRRK2 Shogo Kamikawaji, Genta Ito, Takeshi Iwatsubo Biochemistry 2009 Nov 24;48(46):10963-10975.
新しい論文がThe Journal of Neuroscienceに発表されました
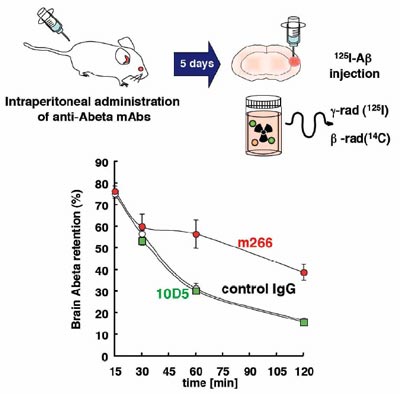
Aβ immunotherapy: intracerebral sequestration of Aβ by an anti-Aβ monoclonal antibody 266 with high affinity to soluble Aβ Kaoru Yamada, Chiori Yabuki, Peter Seubert, Dale Schenk, Yukiko Hori, Sumio Ohtsuki, Tetsuya Terasaki, Tadafumi Hashimoto, Takeshi Iwatsubo The Journal of Neuroscience vol.29 pp. 11393-11398 (2009)
ルツハイマー病の病因にはAβペプチドからなるβアミロイドの脳内蓄積が重要と考えられています。共同研究者のSchenk博士は、Aβを接種したアミロイド前駆体トランスジェニックマウス脳でβアミロイドの蓄積が顕著に抑制されることから「Aβワクチン療法」を開発しました。この効果は血液中に産生された抗Aβ抗体によることが示され、現在ヒト化抗Aβ抗体を投与する受動免疫療法の臨床治験が開始されています。しかし、脳の外から投与された抗体が、どのようなメカニズムによって脳内のAβ蓄積を抑制するのかは不明でした。特に、現在治験の進められている抗体のいくつかは、血液中で作用し、脳からのAβ排出を促進する(「シンク効果」)と信じられてきましたが、それを実証する知見はありませんでした。今回私たちは、シンク効果を生じると考えられてきた代表的なモノクローナル抗体266が、脳からAβを引き抜くのとは逆に、脳内に進入して治療効果を生じていることを示しました。アルツハイマー病の脳では、単量体型で産生されたAβが、障害性の高いオリゴマーを経て、アミロイドとして蓄積するものと考えられています。今回の結果は、抗Aβ抗体が脳内に進入して可溶・単量体型のAβに結合、これをオリゴマーやアミロイド等の多量体の形成過程から隔離し、阻害するという新規の作用メカニズムを提起するものです。以上の研究内容については、こちら(PDFファイル) もご覧ください。
新しい論文がThe Journal of Biological Chemistryに発表されました
Single chain variable fragment against Nicastrin inhibits the γ-secretase activity Ikuo Hayashi, Sho Takatori, Yasuomi Urano, Hiroko Iwanari, Noriko Isoo, Satoko Osawa, Maiko A. Fukuda, Tatsuhiko Kodama, Takao Hamakubo, Tong Li, Philip C. Wong, Taisuke Tomita, and Takeshi Iwatsubo The Journal of Biological Chemistry 2009 Oct 9;284(41):27838-27847. Epub 2009 Aug 14.
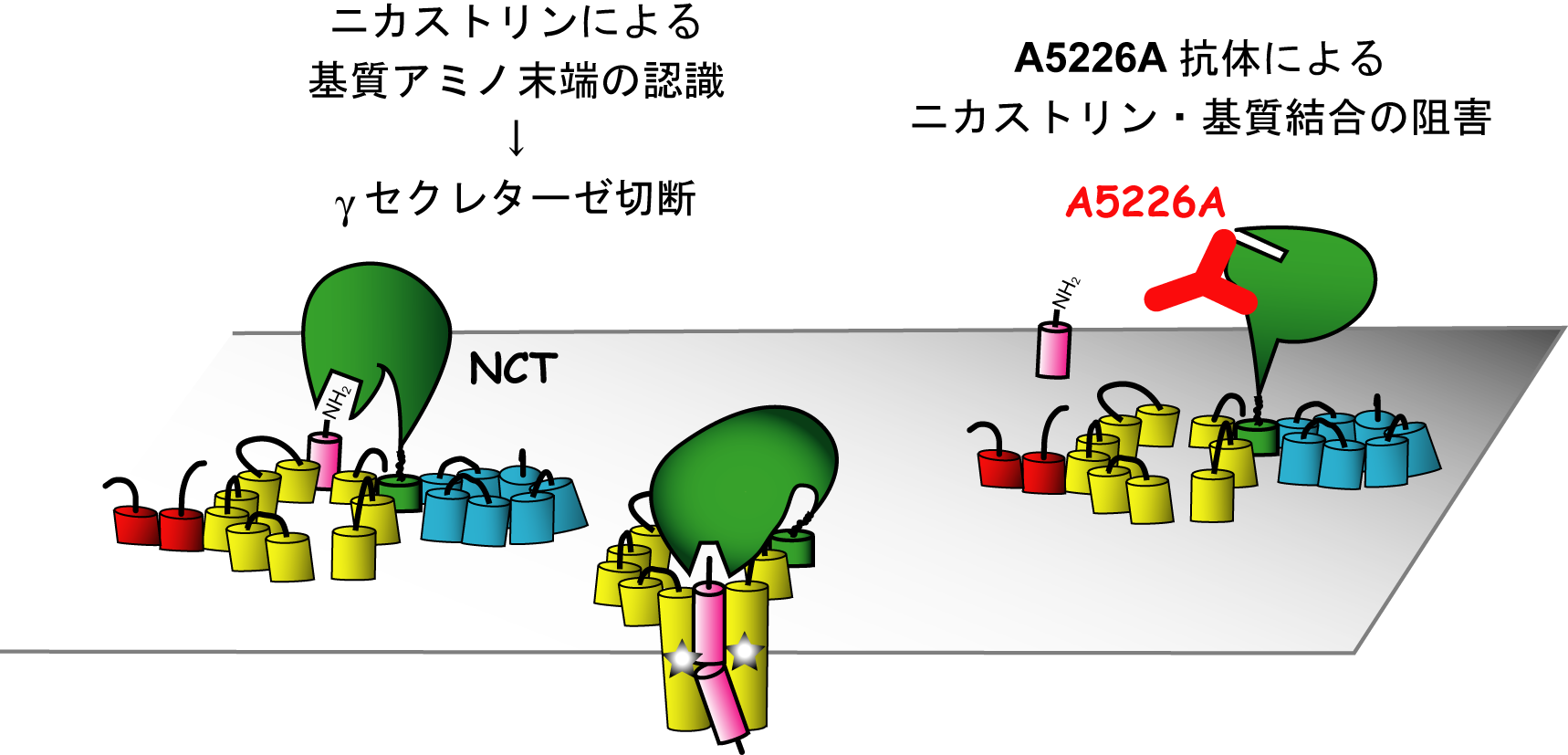
今回、私たちは世界で初めてモノクローナル抗体誘導体を用いたγセクレターゼ活性制御法の開発に成功しました。γセクレターゼはアルツハイマー病脳に蓄積するAβペプチドの産生を行う膜結合型複合体を本態とする酵素です。その構成因子の一つであるニカストリン(Nicastrin)は大きな細胞外領域を持ちます。今回ニカストリンの細胞外領域に対する新規モノクローナル抗体の樹立に成功し、この抗体を基に単鎖抗体を作出しました。この単鎖抗体を培養細胞に発現させたところ、ニカストリン細胞外領域の糖鎖修飾および構造異常を惹起することでγセクレターゼの不安定化を引き起こし、Aβペプチド産生が抑制されることを見出しました。この結果は、ニカストリンの細胞外領域がγセクレターゼの安定性及び活性に重要な役割を果たしていることを示します。またニカストリンがγセクレターゼ活性を制御する創薬標的となりうることを世界で初めて示しました。将来的には、生物製剤の一つとして着目されている「抗体医薬」によるγセクレターゼ活性の制御法開発へつながることが期待されます。本研究は本学先端研 児玉龍彦教授、浜窪隆雄教授との共同研究成果です。
2009年度米国神経科学会(Society for Neuroscience 2009)のプレス向けメディア資料において、当研究室からの下記演題がHot topicsとして選ばれました!
Helical β-peptide foldamers specifically inhibit the γ-secretase activity T. TOMITA, Y. IMAMURA, N. WATANABE, T. IWATSUBO, N. KATO, N. UMEZAWA, T. HIGUCHI
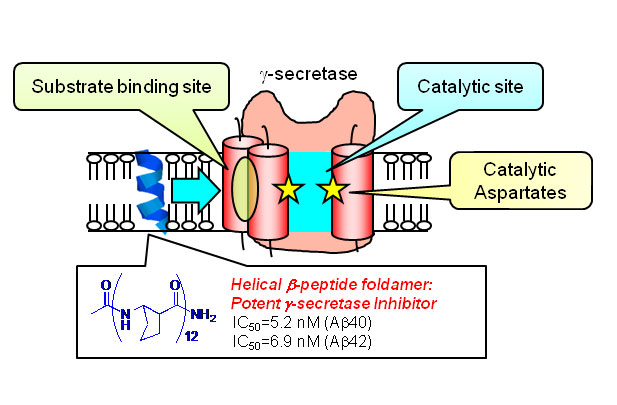
新しい論文がJournal of the American Chemical Societyに発表されました
Inhibition of γ-secretase activity by helical β-peptide foldamers Yuki Imamura, Naoto Watanabe, Naoki Umezawa, Takeshi Iwatsubo, Nobuki Kato, Taisuke Tomita, Tsunehiko Higuchi J Am Chem Soc in press
アルツハイマー病脳に老人斑として蓄積するAβペプチドの産生にかかわるγセクレターゼは重要な創薬標的分子ですが、その単純な阻害は発生・分化にかかわるNotchシグナルの抑制などによる副作用が予見されており、γセクレターゼの基質認識および切断機構に基づいたラショナルな活性制御化合物の開発が求められています。今回βアミノ酸と呼ばれる非天然アミノ酸を用い、基質となる膜貫通領域を模倣するヘリックス構造を固定したβペプチドフォルダマーが強力なγセクレターゼ阻害剤となることを見出しました。また光親和性標識法などのケミカルバイオロジー的手法を駆使することで、その作用点がγセクレターゼの基質認識部位であることを明らかにしました。今後このフォルダマーのデザインを改変していくことで、Aβペプチドの産生のみを特異的に抑制することが可能な、基質特異的γセクレターゼ阻害剤の開発につながることが期待されます。本研究は、名古屋市立大学精密有機反応学分野(樋口恒彦教授、梅澤直樹准教授)との共同研究成果です。
当研究室大学院生の高木さんが平成20年度第2回学生表彰「東京大学総長賞」を受賞しました!
受賞内容要約:γセクレターゼは、アルツハイマー病の病因タンパク質アミロイドβを作り出す酵素であり、根本治療薬開発においてターゲットタンパク質として注目されている。高木氏は、γセクレターゼの詳細な構造をシステイン置換法(SCAM)と呼ばれる手法を用いて解明し、γセクレターゼ阻害剤の分子機構を明らかにした。この研究成果は、治療薬開発において重要な情報をもたらすものであるとして、国際アルツハイマー病学会において多くの研究者や製薬企業からの耳目を集め、アルツハイマー病研究者のためのネットコミュニティAlzforumにおいて高い評価を得た。このような業績および「意志あるところに道あり」をモットーとする研究姿勢が高く評価された。